Periodiek systeem/Stikstofgroep, chemische eigenschappen
Chemische eigenschappen van de stikstofgroep[Bron 1]
Net als andere groepen in het periodiek systeem hebben de verschillende leden van deze groep in hun valentieschil een vergelijkbare verdeling van elektronen, met als gevolg een vergelijkbaar chemisch gedrag.
| Z | Element | Electronen per schil |
|---|---|---|
| 7 | Stikstof | 2, 5 |
| 15 | Fosfor | 2, 8, 5 |
| 33 | Arseen | 2, 8, 18, 5 |
| 51 | Antimoon | 2, 8, 18, 18, 5 |
| 83 | Bismut | 2, 8, 18, 32, 18, 5 |
| 115 | Moscovium | 2, 8, 18, 32, 32, 18, 5
(voorspeld
|
De belangrijkste eigenschap van de elektronenverdeling is dat deze elementen allemaal 5 elektronen in hun valentieschil hebben. Twee bezetten, gepaard, de s-subschil. De drie andere bezetten, ongepaard, drie p-subschil-orbitalen.
De bekendste elementen uit deze groep zijn ook beide belangrijk voor het leven zoals wij het kennen: stikstof is het belangrijkste gas in de atmosfeer, maar ook een component van eiwitten en DNA. Fosfor is eveneens een belangrijk element in DNA, maar speelt ook een rol in het energietransport tussen de plaatsen waar dit in de cel wordt vrijgemaakt en de plekken waar het wordt gebruikt.
Verbindingen
[bewerken]De organische verbindingen van deze groep worden op deze pagina besproken.
Binaire verbindingen van deze groep kunnen gezamenlijk aangeduid worden als pnictides. Deze verbindingen vertonen als groep zeer wisselende eigenschappen. Zo kunnen ze bij kamertemperatuur zowel dia- als paramagnetisch zijn, transparant zijn of elektriciteit opwekken wanneer ze verwarmd worden.
Ternaire verbindingen met lanthanides en een algemene formule , waarin "La" een van de lanthanides is, "M" een element uit de boor- of koolstofgroep en "Pn" voor een van de pnictogenen, maar niet stikstof, staat. Deze stoffen vertonen bindingen met eigenschappen tussen ionbinding en covalente binding.[1]
De elementen uit de stikstofgroep vertonen ook een grote stabiliteit in hun verbindingen door hun vermogen zowel enkelvoudige, dubbele als drievoudige covalente bindingen te kunen vormen. De keerzijde daarvan is hun giftigheid, met name fosfor-, arseen- en antimoon-verbindingen zijn hierom berucht. Reactie van deze stoffen met lichaamseigen materiaal leidt tot de vorming van vrije radicalen die niet makkelijk door de lever verwerkt kunnen worden, waardoor ze daar opstapelen. Paradoxaal genoeg is het juist deze sterke neiging tot bindingsvorming die stikstof en bismut (in verbindingen) relatief minder giftig maken. De sterke bindingen zijn lastig te verbreken, waardoor tamelijk onreactieve moleculen ontstaan. Zo wordt stikstofgas, N2 als inert gas gebruikt, waar argon, of een van de andere edelgassen, te duur zou zijn.
Oxidatiegetallen
[bewerken]De lichtere leden uit de groep, stikstof, fodfor en arseen vormen driewaardig negatieve ionen bij reductie waarmee het octet in de valentieschil vol is. Bij oxidatie wordt bij alle elementen uit deze groep een driewaardig positief ion (alle p-elektronen uit de valentieschil worden afgestaan) of een vijfwaardig positief ion (zowel de p- als de s-elektronen worden afgestaan) gevormd. In de hogere periodes is de vorming van het vijfwaardige ion minder prominent, doordat de s-elektronen zich meer en meer als een inert paar gaan gedragen.[2]
oxidatiegetal −3
[bewerken]De deeltjes die gevormd worden als de leden van de stikstofgroep drie elektronen opnemen zijn nitride, fosfide, arsenide, antimonide en bismutide. Formeel zou hier ook nog moscovide aan toegevoegd kunnen worden. Enige praktische waarde heeft dat echter niet, vooral gezien de korte halfwaardetijden van dit element.
Met waterstof worden door de verschillende elementen hydrides gevormd, zoals ammoniak,fosfine, arsine, stibine en bismutine. Heel strikt sprekend mag je eigenlijk alleen de stikstof- en fosforverbinding een oxidatiegetal van -3 toerekenen, de andere elementen uit de groep zijn minder elektronegatief dan waterstof, en zouden formeel als hydrides benoemd moeten worden. Gaande door de groep naar de hogere perioden, worden de verbindingen steeds giftiger en minder stabiel. De grootte van de hoek tussen de waterstofatomen wordt steeds kleiner, en gaat van de bijna ideale tetraderhoek bij ammoniak (108 °[3]) naar iets meer dan 90 ° bij bismut.[4] De conclusie die uit de bindingshoeken getrokken kan worden is dat het stikstofatoom in ammoniak een vrijwel nette sp3-hybridisatie heeft ondergaan, maar dat in de overige verbindingen het centrale atoom nauwelijks gehybridiseerd is, en de binding vooral via (bijna) standaard p-orbitalen verloopt.
Ook in de smelt- en kookpunten blijkt de stikstofverbinding een speciale plaats in te nemen.
| Naam | IUPAC | Formule | H-X-H (°) | X-H (pm) | sp (°C) | kp (°C) |
|---|---|---|---|---|---|---|
| Ammoniak | Ammoniak | 107,8 | 100,7 | -78 | -33 | |
| Fosfine | Fosfaan | 93,5 | 141,9 | -132,8 | -87,7 | |
| Arsine | Arsaan | 91,8 | 151,9 | -111,2 | -62,5 | |
| Stibine | Stibaan | 91,7 | 170,7 | -88 | -17 | |
| Bismutine | Bismutaan | 90,48 | 177,59 | 16,8 |
Kristalijne vaste stoffen met leden van de stikstofgroep in oxidatietoestand -3 zijn bijvoorbeeld: yttriumnitride, calciumfosfide, natriumarsenide, indiumantimonide en zelfs (drie)dubbelzouten als aluminium-gallium-indiumfosfide. Ook galliumarsenide, na silicium de meest gebruikte halfgeleider, hoort bij deze groep.
oxidatiegetal +3
[bewerken]Van de elementen in deze groep zijn oxo-anionen met dit oxidatiegetal bekend. Stikstof vormt wat formule betreft een uitzondering naast de rest van de elementen. Het nitriet-ion heeft de formule , de andere ionen kunnen met de algemene formule beschreven worden. De ionen zijn: nitriet, fosfiet, arseniet, antimoniet en bismutiet
Stikstof
[bewerken]Er is slechts een beperkt aantal stikstof(III)-verbindingen bekend. Distikstoftrioxide is alleen isoleerbaar als vaste stof of vloeistof bij temeperaturen lager dan −21 °C. Het oxozuur met stikstof(III), salperigzuur is niet stabiel. De halogeenverbindingen en zijn, op stikstoftrifluoride na, allemaal explosieven, waarbij stikstoftrijodide zelfs zo schokgevoelig is dat aanraken met een veer al voldoende is om de explosie in gang te zetten. Overigens is het wel zo dat het jodide en stikstoftribromide formeel als stikstof met oxidatiegetal -3 beschreven zouden moeten worden, omdat de elektronegativiteit van stikstof groter is dan die van broom en jood. Stikstoftrichloride is een twijfelgeval; de eleektronegativiteit van beide elementen is gelijk.
 |
Fosfor
[bewerken]Van fosfor is het trioxide bekend. De structuur van die stof hiernaast geeft meer de indruk van , maar de naam ervoor is al veel eerder toegekend dan dat het mogelijk was dit soort structuren vast te stellen, de verhoudingsformule is uiteraard nog steeds . Verwarring is nauwelijks mogelijk, dus is er ook weinig noodzaak om de naam aan te passen. De stof is stabiel bij kamertemperatuur. Het oxozuur is fosforigzuur, eveneens een stabiele stof. Van de halogenides zijn het fluoride, het chloride en het bromide stabiele stoffen, het jodide is te instabiel om langere tijd opgeslagen te worden, al wordt het wel commercieel aangeboden.[5]

Arseen
[bewerken]Van arseen(III) zijn oxo-verbindingen bekend als arsenieten, arsenigzuur en arseen(III)oxide. Zoals het molecuulmodel hiernaast laat zien, lijkt de structuur van sterk op die van het analoge fosfortrioxide. Net als bij die verbinding zou een beschrijving als beter op zijn plaats zijn. Alle vier de trihalogenides zijn beschreven. De stabiliteit van de halogenides in waterige oplossingen is echter vrij klein: in water ontleden ze allemaal eerst tot arsenigzuur en waterstofhalogenide. Het arsenigzuur vervalt uiteindelijk tot arseen(III)oxide:
De eerste reactie is een evenwicht, de tweede niet. Door het neerslaan van het oxide loopt de reactie af.
Antimoon
[bewerken]Van dit element is antimoon(III)oxide bekend, evenals de vier trihalogenides, deze hebben een trigonale piramide structuur.
Bismut
[bewerken]Het oxidatiegetal +3 is voor bismut het voornaamste. Ten gevolge van relativistische effecten in de hogere periodes is het elektronenpaar in de s-orbitaal nauwelijks beschikbaar voor bindingen (of afstaan). Van bismut(III) zijn de verbindingen met de stabiele halogenides , het oxide, het sulfide, het oxychloride en het oxynitraat bekend.
Moscovium
[bewerken]Voor moscovium(III) wordt een vergelijkbaar gedrag voorspeld als dat van bismut. Dat betekent dat alle vier de trihalogenides stabiel zullen zijn en, op het fluoride na, goed oplosbaar in water. Daarnaast wordt ook de bestaanbaarheid van het oxychloride en oxybromide voorspeld.
Oxidatiegetal +5
[bewerken]De ~aat(V)en en hun zouten
[bewerken]Van alle elementen in de stikstofgroep, met uitzondering van moscovium, zijn zouten bekend, waarin deze elementen met oxidatiegetal +5 deel uitmaken van een oxoanion. Helaas is de situatie niet zo eenvoudig als de in de loop van de geschiedenis opgestelde formules voor de zouten (de kolom "Natrium~aat") doen voorkomen. De nitraten en fosfaten voldoen wel aan de eenvoudige regels. Maar men dacht het al bekende vorm van het zout [w:Natriumantimonaat|natriumantimonaat]] te moeten benoemen als natriumdiwaterstofantimonaatdihydraat . Kristallografisch onderzoek maakte duidelijk dat een betere beschrijving gevormd wordt door natrium[hexahydroxyantimonaat(V)]: .
| Element | ~aat | Formule | Natrium~aat | Formule |
|---|---|---|---|---|
| Stikstof | Nitraat | Natriumnitraat | ||
| Fosfor | Fosfaat | Natriumfosfaat | ||
| Arseen | Arsenaat | Natriumarsenaat | ||
| Antimoon | Antimonaat | Natriumantimonaat | ||
| Bismut | Bismutaat | Natriumbvismutaataat |
De oveeenkomst in naam van de verschillende oxo-anionen (E~aat; E = elementnaam) betekent, zoals uit bovenstaande tabel blijkt, niet ook een algemeen geldende formule of structuur. Voor de vier laatste elementen is als eenvoudigste vorm , al moet voor het bismutaat gezegd worden dat de vorm bestaat ,[6] maar dit is niet de meest gangbare vorm waarin natrium aan bismut met oxidatiegetal +5 gekoppeld is, dat is de vorm zoals in de tabel vermeld is.
Pyro~aten
[bewerken]Naast de in de tabel genoemde verbindingen bestaat er, behalve van de nitraten, ook een pyro-vorm . Pyro is afgeleid van het Oudgriekse woord voor "vuur". Natriumpyrofosfaat en vergelijkbare verbindingen worden in het laboratorium en technisch verkregen door verhitting van dinatriumwaterstoffosfaat:

Het afsplitsen van water en het vormen van ketens beperkt zich voor fosfaten zeker niet tot twee fosfaatgroepen. In levende cellen speelt het koppelen en ontkoppelen van extra fosfaatgroepen een belangrijke rol in het energietransport. De vorming van deze groep pyro-verbindingen verloopt in de cel via de oxidatieve fosforylering. In de figuur hiernaast is ATP, met drie fosfaatgroepen, weergegeven. De energierijke koppeling tussen de fosfaatgroepen is aangegeven met een golfje. Door afsplitsen van één fosfaatgroep ontstaat ADP en komt er energie vrij die gebruikt kan worden voor celactiviteiten. Tijdens de synthese van DNA en RNA worden de verschillende bouwstenen als trifosfaat aangevoerd. Het afsplitsen van 2 fosfaatgroepen levert de energie voor de opbouw van de nucleïnezuren.[7]
De meer gebruikelijke vorm voor het oxobismutaat(V)-ion is vergelijkbaar met die van het nitraat: naast . De reden van het (ten opzichte van de drie andere elementen) afwijkende gedrag van het eerste een laatste stabiele[noot 1] element van deze groep is echter verschillend. Voor stikstof geldt dat naast de beperkte ruimte rond het stikstofatoom voor vier liganden[noot 2] in het vlakke nitraat-ion een grote mate van delocalisatie van de lading mogelijk is.

|
| De verschillende resonatiestructuren voor het nitraat-ion |
Voor bismut geldt een ander verhaal dat vooral vanuit relativistische aspecten benaderd moet worden.
Andere E(V)-verbindingen
[bewerken]Hoewel oxidatiegetal +5 onder de elementen van deze groep dus haalbaar is, geldt dat zoals hierboven al bleek, niet voor het coördinatiegetal. Stikstofpentafluoride is slechts een theoretische verbinding, de synthese laat nog (2024) op zich wachten. De echte coördinatie met 5 liganden, of zelfs 6, is weggelegd voor de niet relativistische leden van deze groep: fosfor, arseen en antimoon. Dit blijkt uit het bestaan van zowel hun oxides als hun fluorides en hexafluoride-anionen, die als niet-coördinerende anionen een rol spelen in het onderzoek van extreem elektrofiele kationen. In deze stoffen worden de centrale atomen hypervalent genoemd omdat ze meer dan 8 elektronen in hun valentieschil hebben. Niet alleen de s- en p-orbitalen van de buitenste elektronenschil zijn bij de bindingen betrokken, maar ook de daarbinnen liggende d-orbitaal.
| Element | Oxide | Fluoride | Hexafluoro-anion |
|---|---|---|---|
| Stikstof | N2O5 | NF5 ? | - |
| Fosfor | P2O5 P4O10 |
PF5 | [PF6]- |
| Arseen | As2O5 | AsF5 | AsF6- |
| Antimoon | Sb2O5 | SbF5 | SbF6- |
| Bismut | Bi2O5 | SbF5 | SbF6- |
Stikstof
Voor stikstof is oxidatiegetal +5 vooral een didactisch/practische benadering voor de beschrijving van moleculen als , distikstofpentaoxide. De hoge elektronegativiteit van stikstof heeft tot gevolg dat de elektronen vrijwel gelijkwaardig tussen de atomen verdeeld worden.
 |
Fosfor
Dit element heeft dus geen enkele moeite met 5- of 6-coördinatie, zoals uit bovensaande voorbeelden blijkt. Het zwavelanalogon van fosforpentoxide, fosforpentasulfide heeft dezelfde molecuulstructuur, waarin de zuurstofatomen zijn vervangen door zwavel. De formule van de stof is dus .Daarnaast zijn er ook oxyhalogenides bekend zoals fosforylchloride en gemengde halogenides als fosfortrichloordifluoride .
Bismuth
Van bismut zijn verbindingen bekend met een oxidatiegetal +5, zoals uit de tabel hierboven blijkt, maar het relativistische effect op de s-elektronen wordt steeds belangrijker zodat het zich vooral als een inert paar gaat gedragen. is instabiel, Concise encyclopedia chemistry p. 136 Uitgever: Walter de Gruyter ISBN 978-3-11-011451-5</ref> en is veel reactiever dan de andere pentafluorides uit de stikstofgroep, waardoor het een zeer goed fluoriderend reagens is.[8]
Moscovium
Het inert paar effect voor de s-elektronen is in moscovium nog meer uitgesproken dan in bismut. Er zijn van dit element geen verbindingen bekend met een oxidatiegetal van +5.
Andere oxidatiegetallen
[bewerken]- Van stikstof is een groot aantal oxides, binare verbindingen met zuurstof, bekend. Naast de hierboven al genoemde oxidatiegetallen zijn ook die met +1 (lachgas), +2 en +4 bekende verbindingen, evenals gemengde valentieverbindingen en zelfs een +6 verbinding in het zeer instabiele nitraat-radicaal
- In hydrazine, difosfaan en organische derivaten van deze twee verbindingen is het oxidatiegetal -2; een binding tussen twee gelijke atomen draagt niet bij aan het oxidatiegetal. Om dezelfde reden is het oxidatiegetal in diazeen -1, de dubbele band tussen de stikstofatomen laat nog maar 1 binding over om bij te dragen aan het oxidatiegetal.
- Op vergelijkbare manier heeft arseen in realgaar oxidatiegetal +2
- Van antimoon is een vergelijkbare verbinding gekend: tetrafenyldistibaan , antimoon heeft hier eveneens +2 als oxidatiegetal.
|

|

|
| Onderfosforigzuur | Hypfosforzuur |
- Op basis van de molecuulformules is er van fosfor een serie oxidatiegetallen te berekenen: 3, 3½, 4, 4½ en 5. Voor deze stoffen kunnen de formules , , , en genoteerd worden. Een nadere beschouwing leert dat het in feite gaat om een stapsgewijze oxidatie van fosfortrioxide naar fosforpentoxide. Onderstaande figuur maakt dat duidelijk.

- Antimoontetroxide is een gemengde valentieverbindingen. De verhoudingsformule is wel is waar (wat tot oxidatiegetael +4 zou leiden), maar het tetra (vier) in de naam verwijst naar het feit dat er vier zuurstofatomen gecombineerd zijn met twee soorten antimoon-ionen in het kristal, de helft met oxidatiegetal +3, de ander helft met +5.
- Voor moscovium wordt verwacht dat relativistische effecten zowel de elektronen in de 7s- als die in de 7p1/2-orbitalen deze vrijwel inert zullen maken. De bindingsenergie van het ongepaarde elektron in de 7p3/2-orbitaal is lager dan die in de 7p1/2-orbitalen. Deze voorspelling ten aanzien van de bindingsenergie leidt er ook toe dat verwacht wordt dat oxidatiegetal +1 voor moscovium een promenentie plaats zal innemen, sterker dan bij bismut, waar het slechts een ondergeschikte rol speelt.[9]
Directe binding E-E
[bewerken]In de koolstofgroep is het gegeven van een serie gelijke atomen die direct aan elkaar gebonden zijn, en een keten of ring vormen, een standaard gegeven. Binnen de stikstofgroep is dit een veel minder vaak voorkomende situatie.
Stikstof
[bewerken]- 2 stikstofatomen
- Van stikstof zijn een aantal verbindingen bekend die onder deze groep te rangschikken zijn. Als eerst is daar natuurlijk distikstof, het voornaamste bestanddeel van de atmosfeer van de aarde. Wat bindingen betreft is het isoelektronisch met ethyn. De hogere lading van de stikstofkern maakt de waterstofatomen in vergelijking met die stof overbodig en de elektronen tot een vrij paar.
- Van stikstof zijn een aantal verbindingen bekend die onder deze groep te rangschikken zijn. Als eerst is daar natuurlijk distikstof, het voornaamste bestanddeel van de atmosfeer van de aarde. Wat bindingen betreft is het isoelektronisch met ethyn. De hogere lading van de stikstofkern maakt de waterstofatomen in vergelijking met die stof overbodig en de elektronen tot een vrij paar.

|

|

|

|
- Is distikstof vergelijkbaar met ethyn, diazeen kan wat zijn elektronenstructuur betreft naast etheen gelegd worden. Opnieuw ontbreken, net als bij distikstof, twee waterstofatomen. De dubbele binding is, zoals ook bij etheen, niet draaibaar, waardoor er twee isomeren van diazeen bestaan: een E- en een Z-vorm, vergelijkbaar met etheen. in de figuur hiernaast zijn de structuren naast en boven elkaar weergegeven.
- Er is wel een verschil tussen de koolstof- en de stikstofverbindingen: In de koolstofverbindingen is de configuratie absoluut: een molecuul in de E-vorm zal niet zomaar overgaan in de Z-vorm. Bij de stikstofverbinding gaat het duidelijk om een evenwicht. Bij reacties kan, als slechts één van de twee isomeren reageert, het evenwicht naar het reagerende isomeer aflopen.
- Net als de twee vorige voorbeelden van moleculen met twee direct gebonden stikstofatomen is ook de verzadigde variant, , onder de naam hydrazine een bekende verschijning in de chemie. In de structuurformule lijkt hydrazine sterk op etheen, in het ruimtelijke model ernaast is duidelijker te zien dat de structuur meer op die van ethaan lijkt.[noot 3] De vrije elektronenparen nemen de plaats in van de ontbrekende waterstofatomen. Hydrazine dankt zijn bekendheid vooral aan het gebruik als raketbrandstof.
- Drie stikstofatomen
- Drie stikstofatomen direct aan elkaar gekoppeld komt als stabiele structuur eigenlijk alleen voor in het azide-ion. Het middelste atoom heeft hierbij een sp1-, de buitenste twee een sp2-hybridisatie. Verdeling van de 21 elektronen in de drie atomen leidt tot:
- Uit bovenstaande tabel wordt duidelijk dat in het neutrale -deeltje de laatste bindende orbitaal slechts half bezet is. Hier kan eenvoudig een elektron in worden opgenomen, waarmee een ion ontstaat met 22 elektronen en slechts een totale kernlasding van 21+. Hiermee is zowel de vorm als de lading van het azide-ion verklaard: een lineair -ion. Dat wil overigens niet zeggen dat de zouten van dit anion echt stabiel zijn. lood(II)azide , kwik(II)azide en w:ThalliumazideThalliumazide zijn allemaal schokgevoelige verbindingen die bij verhoogde temperatuur ontleden of ontploffen. De alkalizouten, zoals (natriumazide , zijn beter hanteerbaar, maar nog steeds explosief en giftig.
- Triazaan

- Hoewel niet als erg stabiele vorm, is triazaan wel een bekende verbinding. In de vorm van zijn sulfaat of als hydrochloride is het geïsoleerd. De neutrale verbinding kon niet uit deze zouten bereid worden: pogingen daartoe leidde tot ontleding naar ammoniak en diimide.[10]. Een wel gelukte synthese maakt gebruik van het bestralen van ammoniak-ijs (-78 °C) met elektronen. Na sublimatie kon triazaan als een stabiel molecuul in de gasfase worden aangetoond.[11]
Fosfor
[bewerken]| Van fosfor zijn verschillende verbindingen bekend waarin een directe binding tussen twee fosfor-atomen voorkomt. In witte fosfor, , is fosfor een moleculaire stof met de structuur van een tetraëder. Deze variant van fosfor is giftig. Rode fosfor heeft een totaal andere structuur. De fosforatomen zijn gerangschikt in een lange reeks van zeshoeken die een zijde met elkaar delen. De fosforatomen die geen deel uitmaken van twee ringen zijn in een brug door een fosfor-atoom verbonden. Met de derde binding van de bruggende fosforatomen worden ze of aan elkaar gekoppeld, of wordt een extra fosforatoom gebonden dat dan gebruikt wordt om verschillende reeksen aan elkaar te koppelen. In de figuur hiernaast zijn dat de fosforatomen met een sterretje. |  |
| Ook van fosfor zijn verbindingen bekend die (hier in hun valentieschil) iso-elektronisch zijn met alkanen. In tegenstelling tot het stikstofanaloog is difosfaan niet basisch. Het vrije elektronenpaar bevindt zich in een orbitaal met overwegend s-karakter en is daarmee niet beschikbaar voor het vormen van een waterstofbinding. Naast het ontbreken van basische eigenschappen is een ander gevolg daarvan de gering oplosbaarheid van de stof in water, en juist een goede oplosbaarheid in organische oplosmiddelen. |  Difosfaan |
| Een totaal andere situatie treedt op in de Hypofosforzuren. Hierin treedt ook een directe binding op tussen twee fosfor-atomen, maar in tegenstelling tot de verbindingen hierboven waarin alleen fosfor een rol speelde, vormen de fosfor-atomen hier de keten, maar is deze "aangekleed" met zuurstofatomen. De structuur kan het beste beschreven worden met: . Met deze formule zijn zuren bekend met n = 1 (maar dat is "gewoon" fosforzuur) tot en met n = 4. In water geven deze hypofosforzuren aanleiding tot de ionen , en . | 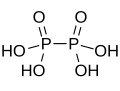 Hypofosforzuur |
Naast de hierboven besproken enkele bindingen tussen fosfor-atomen is et ook mogelijk verbindingen te maken met een dubbele binding tussen twee fosfor-atomen. Onderstaande synthese is een voorbeeld, de tert-butylgroepsubstituenten op de ortho-posities ten opzichte van de fosfor-atomen vormen een sterische barriere voor het ondergaan van reacties:

Antimoon
[bewerken]Formeel is antimoon in op hydrazine lijkende verbindingen tweewaardig. In deze distibines is een enkelvoudige binding aanwezig tussen twee antimoon-atomen. Een aantal van deze verbindingen vertoont thermochromisme: zo is bijvoorbeeld tetramethyldistibine een kleurloos gas, maar bij afkoelen wordt het een gele vloeistof. Uiteindelijk ontstaat een rode vaste stof, net onder het smeltpunt van 18,5 °C, en ruim onder het smeltpunt wordt de vaste stof weer geel.[12]
Interelement-binding
[bewerken]
Naast de bindingen met elementen uit andere groepen uit het periodiek systeem of met zichzelf zijn er ook verbindingen bekend met directe bindingen tussen elementen uit de stikstofgroep.[13]

Samenvatting
[bewerken]| Element | E1 | E2 | E3 | E4 |
|---|---|---|---|---|
| N | NH3 | N2H4 | N3H5 | N4H6[14] |
| P | PH3 | P2H4 | P3H5 | |
| As | AsH3 | [15] | [16] | |
| Sb | SbH3 | |||
| Bi | BiH3 |
Noten in de tekst
[bewerken]- ↑ Formeel is bismut geen stabiel element, maar de grootte van de halwaardetijd is dusdanig dat het wel als zodanig gezien kan worden, zie Isotopen van bismut
- ↑ De beperkte ruimte rond stikstof voor vier liganden is geen absolute reden waarom het nitraat-ion slechts drie zuurstofatomen telt, maar het speelt wel mee.
- ↑ Voor het mooi zouden de vrije elektronenparen aangegeven kunnen zijn: een soort "smurfenstaartje" op het rechter (blauwe) stikstofatoom, een neusje op het linker.
- ↑ Op elk van de twee eindstandige stikstofatomen zijn 2 sp2-orbitalen aanwezig.
- ↑ Elk van de eindstandige stikstofatomen heeft een niet gehybridiseerde π-orbitaal. Deze kunnen elk met één van de resterende p-orbitalen op het centrale stikstofatoom een p-binding vormen. De resulterende π-bindingen zullen loodrecht op elkaar staan.
Bronnen
[bewerken]- ↑ Deze paragraaf is een vertaling van de tekst in het lemma Pnictogen op de Engelse Wikipedia, paragraaf "Chemical" zoals deze op 20 december 2023 aanwezig was.
Noten in de tekst
[bewerken]
Verwijzingen in de tekst
[bewerken]- ↑ "Pnicogen – Molecule of the Month". University of Bristol
- ↑ Boudreaux, Kevin A. "Group 5A — The Pnictogens". Department of Chemistry, Angelo State University, Texas
- ↑ (1997) Chemistry of the Elements (2nd) p. 423 Uitgever: Butterworth-Heinemann ISBN 0-7506-3365-4
- ↑ Jerzembeck W, Bürger H, Constantin L, Margulès L, Demaison J, Breidung J, Thiel W (2002). Bismuthine BiH3: Fact or Fiction? High-Resolution Infrared, Millimeter-Wave, and Ab Initio Studies. Angew. Chem. Int. Ed. 41 (14): 2550–2552. PMID: 12203530. DOI: <2550::AID-ANIE2550>3.0.CO;2-B 10.1002/1521-3773(20020715)41:14<2550::AID-ANIE2550>3.0.CO;2-B.
- ↑ L. G. Wade, Jr., Organic Chemistry, 6th ed., p. 477, Pearson/Prentice Hall, Upper Saddle River, New Jersey, USA, 2005.
- ↑ Sascha V (2004). Konformationsaufklärung anorganischer Oxoanionen des Kohlenstoffs und Festkörpersynthesen durch Elektrokristallisation von Ag3O4 und Na3BiO4 (PDF) (Ph.D.) (in German). Max-Planck-Institut für Festkörperforschung, Stuttgart. doi:10.18419/opus-6540.
- ↑ Bell SP, Dutta A. (2002). DNA Replication in Eukaryotic Cells. Annual Review of Biochemistry 71: 333-374.
- ↑ Sjabloon:Greenwood&Earnshaw2nd
- ↑ Keller, O. L. Jr., C. W. Nestor, Jr., (1974). Predicted properties of the superheavy elements. III. Element 115, Eka-bismuth. Journal of Physical Chemistry 78 (19): 1945. DOI: 10.1021/j100612a015.
- ↑ (de) A. F. Holleman, E. Wiberg, N. Wiberg, Lehrbuch der Anorganischen Chemie, 101e editie, Walter de Gruyter, Berlin 1995,pag. 669–670. ISBN:3-11-012641-9
- ↑ Förstel, Maksyutenko, Jones, Sun, Chen, Chang, & Kaiser. "Detection of the Elusive Triazane Molecule (Sjabloon:Chem) in the Gas Phase", ChemPhysChem, 2015, 16, 3139.
- ↑ H.J. Breunig, R. Rosler: Organoantimony compounds with element-element bonds, Coordination Chemistry Reviews, 163 Pag. 33-53 (1997)
- ↑ (1974) Inorganic Syntheses ISBN 9780470132463
- ↑ Als verontreiniging in triazine-monsters.
- ↑ Diarsaan, As2H4, is gedetecteerd, maar instabiel boven -100 °C
- ↑ Triarsaan, As3H5, is gedetecteerd



















![{\displaystyle {\ce {( \ [BiO]Cl \ )}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6fd0cda549f54364bb7c92426ffe4b53a5ebcd85)
![{\displaystyle {\ce {( \ [BiO][NO3] \ )}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/20a0f077165431a2a488074c41d7042424e68f3c)

![{\displaystyle {\ce {Na[Sb(OH)6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e62fd23153b1b2abf9b6dc4bbf5d1d898334ceed)












![{\displaystyle {\ce {([O3E-O-EO3]^{4-})}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/26fee3f5630918598fc75545cad5f5ad1e1b7221)
![{\displaystyle {\ce {2Na2HPO4.H2O\ ->[{\ce {450-500\ ^{o}C}}]\ Na4P2O7\ +\ 3H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7442c5e0b43538fdef87dde15f7659dd3e87d63f)




















![{\displaystyle {\ce {( \ [N3H8^{3+}]2[SO4^{2-}]3 \ )}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d5297d9b5ef6e0445a4136f63a1342298d6741cb)
![{\displaystyle {\ce {( \ [N3H6^{+}][Cl^{-}] \ )}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/12ea1a314165ae0624821ffb30dcdc12a5084ad2)



![{\displaystyle {\ce {HO-[P(O)(OH)]_{n}-OH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b630fa2a2f933b60888c17b5794b33fa0dd1b52f)


