Periodiek systeem/Alkalimetalen, pseudo-alkalimetalen
Naast de echte alkalimetalen is er nog een groep stoffen die een grote neiging hebben tot de vorming van monovalente positieve ionen. Analoog aan de pseudohalogenen worden deze stoffen soms aangeduid als pseudo-alkalimetalen. Deze groep omvat een aantal elementen en een groep meer-atomige ionen. Deze laatste lijken heel sterk op de alkali-ionen in hun omvang en zwakke polariserende vermogen. [2]
Waterstof
[bewerken]Het element waterstof, met slechts 1 elektron per atoom, wordt gewoonlijk boven aan groep 1 in het periodiek systeem geplaatst op basis van zijn elektronenconfiguratie. Anderzijds wordt ewaterstof nomraal gesproken niet tot de alkalimetalen gerekend.[3] Metallische waterstof, alleen bestaanbaar bij zeer hoge drukken is vooral bekend om zijn elektrische en magnetische eigenschappen, niet vanwege zijn chemie.[4] Onder Standaardomstandigheden bestaat waterstof als een twee-atomig gas, twee waterstof-atomen per molecuul ,[5] een eigenschap die ook voorkomt bij de alkalimetalen die in de gasfase twee-atomige moleculen vormen, zoals dilithium .[6]
Waterstof heeft, zoals de alkalimetalen, 1 valentie-elektron[7] en reageert makkelijk met de halogenens,[7] maar daar houdt de gelijkenis vrijwel meteen op ook, vooral door de kleine maat van het -ion in vergelijking met die van de metalen.[7][3] Een plaatsing boven fluor komt ook voor, maar ook daar is de chemische overeenkomst maar matig.[8]
De eerste ionisatiepotentiaal van waterstof, 1312,0 kJ/mol, is veel hoger dan die van de alkalimetalen.[9][10] Omdat er maar 1 elektron nodig is om de buitenste valentieschil van waterstof geheell te vullen, gedraagt waterstof zich soms als een halogeen, waarbij het negatieve hydride-ion gevormd wordt. De alkalimetalen kunnen ook negatieve ionen vormen, de alkalides, maar dit zijn vooral zeer instabiele laboratorium-curiositeiten. [11][12] Een argument tegen de plaatsing van waterstof als eerste halogeen is dat de vorming van een hydride-ion endotherm is, terwijl de vorming van de halide-ionen een exotherm proces is. De straal van het hydride-ion past ook niet in de trend bij de halogenen: een steeds grotere ionstraal gaande door de kolom naar beneden: het -ion is een erg diffuus deeltje met de elektronen op relatief grote afstand van het proton.[13] Enige tijd is gedacht dat vloeibaar waterstof meer metaalachtige eigenschappen zou hebben,[8] maar dit bleek niet het geval. Alleen onder de zeer extreme omstadigheden van hoge druk zoals deze in de kern van de planeten Jupiter en Saturnus bestaat wordt waterstof metallisch en gedraagt zich als een alkalimetaal. Deze toestand staat bekend als Metallische waterstof.[14] De soortelijke weerstand van vloeibaar metallische waterstof bij 3000 K is ongeveer gelijk aan die van vleoibaar rubidium en cesium bij 2000 K bij de drukken waarbij de overgang tussen niet-metaal en metaal optreedt..[15]
De -elektronenconfiguratie van waterstof, hoewel analoog aan die van de alkalimetalen, is in het periodiek systeem uniek, want er hoort geen -subschil bij. Hierdoor is het mogelijk een elektron kwijt te raken en het hydron of er een opnemen en hydride vormen.[16] In het eerste geval lijkt het dan oppervlakkig op de alkalimetalen, in het tweede op de halogenen. Het gemis van de 1p-schil is belangrijk genoeg om watertsof in geen van de twee groepen goed te laten passen.[16] Met zijn half-gevulde valentieschil en op thermodynamische gronden (ionisatie-energie en elektronenaffiniteit) , waterstof kan niet tetravalent zijn. Geen van de drie groepen voldoet dus echt, maar moet erg gekozen worden, dan is groep 1 de meest gebruikelijke plek.[8] Als voorbeeld van de uitzonderlijke eigenschappen van waterstof kan de, in vergelijking met de alkali-ionen, zeer kleine straal van het ion genoemd worden: 150 fm, ongeveer een factor 1000 kleiner dan de meeste ionstralen. In vloeistoffen en vaste stoffen bestaat het waterstof-ion alleen in combinatie met andere deeltjes, en het uitwisselen van tussen deeltjes is de basis van de zuur-base-chemie.[16] De vorming van waterstofbruggen is een andere, aan de kleine afmetingen van het ion gekoppelde eigenschap.[8] Analoge bindingen zijn ook van lithium bekend, maar op veel kleinere schaal.[8] Ondanks zijn maat kan waterstof in een aantal kristallen toch d eplaats innemen van alkali-metalen, waarbij sterke overeenkomsten met de lichterealkali-metalen, met name lithium, op de voorgrond treden.[17]

|
| Oppervlakkig vergelijkbaar met de alkali-metalen, maar op een totaal andere chemische basis, reageert ammoniak met waterstofchloride en wordt het zout ammoniumchloride gevormd. |
Ammonium en zijn derivaten
[bewerken]Het ammonium-ion heeft eigenschappen die sterk overeenkomen met de zwaardere alkali-metalen en gedraagt zich als zodanig alsof het tussen kalium en rubidium in de rij past.[2][18][19][20][21] Zo zijn vrijwel alle alkali-zouten goed oplosbaar in water, een eigenschap die de meeste ammoniumzouten delen.[22] Verwacht wordt dat het ammonium-ion zich bij hoge drukken > 100 GPa als een metaal gedraagt: positieve -ionen ingebed in een zee van elektronen, vegrelijkbaar met de metaalbinding. Deze situatie kan optreden in de reuzenplaneten uranus en Neptunus, daarmee een belangrijke bijdrage leverend aan het magneetveld van deze planeten.[20][21] Geschat wordt dat de overgang van een mengsel van ammoniak en diwaterstof naar metallischa ammoniak plaatsvindt nett onder een druk van 25 GPa.[20] Onder standaardomstandigheden kan ammoniak een amalgaam vormen met kwik[23]
Andere pseudo-alkali-metalen in deze groep zijn de alkylammonium-ionen, ionen waarin een of meer van de waterstofatomen in het ammonium-ion vervangen zijn door alkylgroepen.. Vooral de [[w:Quarternair ammonium ion|quarternaire ammonium-ionen zijn zeer ruikbaar omdat de lading niet afhankelijk is van een zuur-base-evenwicht. Zuij worden vaak gebruikt als goedkoop alternatief voor cesium om grote, makkelijk te polariseren anionen te stabiliseren, bijvoorbeeld .[24] Tetraalkylammoniumhydroxides, net als de alkalihydroxides, zijn sterke base die met atmosferische koolstofdioxidegas tot carbonaten reageren.[25]
Het stikstof=atoom in ammoniak kan vervangen worden door fosfor, arseen of antimoon (de zwaardere niet-metalen uit de stikstofgroep) waarbij fosfonium- en arsonium-ionen gevormd worden. Stibonium zelf is niet bekend (juni 2023), maar een aantal organische derivaten is beschreven.[2]
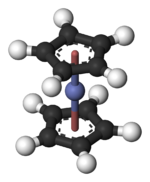
|
| Molecuulmodel van kobaltoceen. Kobalt gesandwiched tussen twee cyclopentadiënylringen. |
Cobaltoceen end derivaten
[bewerken]Kobaltoceen, , is een metalloceen, het kobalt-analogon van het bekendste lid van die groep: ferroceen. Kobaltoceen is een puperen vaste stof. In dit metalloceen komen 19 valentie-elektronen voor, een meer dan gewoonlijk wordt aangetroffen in metallocenen en het zeer stabiele ferroceen. Kobaltoceen voldoet hiermee niet aan de 18-elektronenregel, en het 19e elektron bezet een antibindende Co-C-orbitaal. Veel reacties van kobaltoceen worden gekenmerkt door de neiging dit "extra" elektron af te staan waarbij een stabiele 18-elektronen situatie ontstaat, bekend onder de naam kobaltocenium.
Veel kobaltocenium-zouten vormen een coprecipitaat met ceriumzouten en kobaltoceniumhydroxide is een sterke base die koolstofdioxide uit de lucht absorbeert en kobaltoceniumcarbonaat vormt.[25] Net als de alkalimetalen is, zoals eerder aangegeven, kobaltoceen een serke reductor, en decamethylcobaltoceen is zelfs nog sterker.[26] Kobalt kan vervangen wordne door zijn zwaardere analogon rodium in rodoceen, een nog sterkere reductor.[27] Iridoceen (met iridium) is waarschijnlijk een nog sterkere reductor, maar nog weinig bestudeerd in verband met zijn instabiliteit.[28]

|
| Zeer zuivere stukjes thallium in een glazen ampul onder argon |
Thallium
[bewerken]Thallium is het zwaarste stabiele element in groep 13, de boorgroep. Aan de onderzijde van het periodiek systeem worden de relativistische effecten steeds sterker, wat resulteert in de vorming van een inert elektronenpaar, waardoor de effectieve ion-lading van het element 2 lager wordt dan het groepsnummer zou doen vermoeden. De extra energie die vrijkomt bij het vormen van twee extra (ionogene) bindingen weegt niet op tegen de ionisatie-energie van de 6s-elektronen.[29] Het oxidatiegetal voor veel thalium-vebrindingen is (+1),[30] overeenkomend met dat van alle bekende alkali-metalen.[30]Thallium(I)-verbindingen vertonen veel gelijkenis met kalium- of zilver-verbindingen grotendeels door de overeenkomende ionstralen: (164 pm), (152 pm) en (129 pm).[31][32]
Kort na zijn ontdekking en in een aantal eerdere versies van het periodiek systeem (Mendelejev in 1869 en Meyer in 1868.[33]) werd thallium bij de alkalimetalen ingedeeld,[32] meteen na cesium als zesde in de groep, Meyer in 1870 en Mendelejev in 1871 plaatsten thalium in de boorgroep en lieten de plaats onder cesium leeg.[33]
Thallium vertoont echter ook oxidatiegetal (+3),[30] dat bij geen enkel alkalimetaal aangetroffen wordt,[30] hoewel voor Uue, het nog niet ontdekte alkalimetaal in periode 9, deze oxidatietoestand voorspeld wordt.[34] Francium heeft de plaats van thallium overgenomen als zesde alkali-metaal.[35] Terwijl gestabiliseerd wordt door het inert-paar-effect, speelt dit elektronenpaar wel een rol in een aantal stereochische aspecten van thallium(I)-verbindingen in waterige oplossingen. is slecht oplosbaar in water en heeft een ongebruikeleijke tengevolge van het inerte elektronenpaar.[36]

|
| Koper |

|
| Zilver |

|
| Goud |
Koper, zilver en goud
[bewerken]De elementen van groep 11, koper, zilver en goud, zijn typische elementen van de overgangsmetalen, gegeven het feit dat ze ionen vormen met incomplete d-schillen. Fysisch hebben ze de relatief lage smeltpunten en hoge elektronegativiteit die meestal geassocieerd worden met de hoofdgroep-metalen van de groepen 13 tot 17. De gevulde d-subschil en het vrije elektron in de s-subschil dragne bij aan hun hoge thrmische en elektrische geleidbaarheid. In de overgangsmetalen met lagere groepsnummers (meer naar links in het periodiek systeem) ondervinden interacties tussen de gedeeltelijk gevulde d-subschil en de s-elektrone in de buitenste schil, waardoor de elektronenmobiliteit lager wordt.[37] Chemisch gedragen de groep 11-elementen zich in hun valentie (+1) als hoofdgroep-metalen en zijn daardoor gerelateerd aan de alkali-metalen. In de versie van het periodiek systeem die een groot deel van de 20e eeuw gebruikt werd, vormden deze elementen de groep IB, paralel aan de alkali-groep IA.[38]
De spectra van deze elementen zijn analoog aan die van de alkalimetalen,[39] de monovalente ionen zijn paramagnetisch en ze dragen niet bij aan enige kleur van hun zouten. Als het anion geen kleur levert zijn de zouten wit.[40]
In Mendeleev's 1871 periodieke systeem stonden koper, zilver en goud twee keer genoteerd: een keer onder groep VIII, een verzameling die nu de ijzer-, kobalt- en nikkelgroep omvat en een keer als groep (IB). De laatste groep stond tussen haakjes om aan te geven dat daar nog twijfel over was. Mendeleev's voornaamste selectiekriterium was de hoogste oxidatietoestand van een element, en van koper was het tweewaardige ion bekend en van goud het driewaardige. Dat paste dus niet in een 1B-groep.[39] Maar, systeem is systeem. Als de IB-groep geschrapt werd, maakte dat groep I de enige groep zonder A/B onderscheid.[39] Korte tijd later verkoos een meerderheid van de chemmici deze elementen in groep IB te plaatsen en niet in groep VIII: het resultaat was veel meer symmetrisch. De elementen van groep I werden in twee kolommen genoteerd, aan de ene zijde de alkali-metalen aan de andere zijde de kopergroep. Met de introductie van het 18-koloms periodieke systeem werd een echte visuele scheiding gerealiseerd tussen deze elementen en de alkali-metalen.[39]
De elementen van de kopergroep bleven dus nog lang een soort ondergroep van de alkalimetalen. De huidige atoomtheorie geeft daar een goede verklaring voor: beide hebben een s1-elektronen configuratie. De alkalimetalen hebben dit boven een geheel bezette p-subschil, de kopergroep boven een geheel gevulde d-subschil. De overeenkomsten blijven overigens vooral beperkt tot de stoichiometrie van de (+1)-verbindingen, enstrekken zich niet uit tot andere chemische eigenschappen.[41] De oorzaak hiervan ligt bij de d-subschil, die veel minder afschermd dan de gevulde p=subschil: de metalen van de kopergroep hebben een veel hogere eerste ionisatiepotentiaal en veel kleinere ionen dan de overeenkomende alkalie-metalen.[41] Daarnaast spelen uiteraard de hogere smeltpunten, hardheid, dichtheid, lagere reactiviteit en oplosbaarheid in vloeibare ammoniak en het meer covalente karakter van hun verbindingen.[41] Als laatste is uiteraard ook waar dat de alkalimetalen de laagste waarden in de lijst van elektrodepotentialen vertegenwoordigen en de metalen uit groep 11 wel is waar niet de hoogste waarden hebben in die lijst, maar toch duidelijk een stuk hoger dan de alkalimetalen.[41]
De gevulde d-subschil van groep 11 wordt makkelijker verstoord dan de volle p-subschil zodat de tweede en derde ionisatiepotentaal van deze metalen een stuk lager is dan die van de alkali-metalen. Hogere oxidatiegetallen dan (+1) zijn mogelijk, evenals een rijkere coördinatie-chemie. De groep 11 elementen krijgen daardoor duidelijk een meer overgangskarakter.[41] Vooral opmerkelijk in deze lijst met verschillen tussen groep 1 en groep 11 is de verbindingen van goud met rubidium en cesium, waarin goud als auride aanwezig is. Goud gedraagt zich hier als een pseudo-halogeen dat zijn valentieschil aanvult tot en gevulde schil: en zo de gesloten subschil-structuur van [[w:Kwik|kwik] realiseert.[41]
- ↑ Deze pagina is een vertaling van de tekst in het lemma Alkali metal op de Engelstalige Wikipedia, paragraaf Pseudo-alkali metals zoals deze op 28 juni 2023 aanwezig was.
- ↑ 2,0 2,1 2,2 Dietzel, P. D.; Kremer, R. K.; Jansen, M. (8 January 2007). Superoxide compounds of the large pseudo-alkali-metal ions tetramethylammonium, -phosphonium, and -arsonium.. Chemistry: An Asian Journal 2 (1): 66–75. PMID: 17441140. DOI: 10.1002/asia.200600306.
- ↑ 3,0 3,1 International Union of Pure and Applied Chemistry > Periodic Table of the Elements. IUPAC.
- ↑ Folden, Cody (31 January 2009). The Heaviest Elements in the Universe. Saturday Morning Physics at Texas A&M.
- ↑ J. Emsley: (1989) The Elements Uitgever: Oxford: Clarendon Press
- ↑ Winter, Mark J. (1994) Chemical Bonding, Oxford University Press, ISBN: 0-19-855694-2
- ↑ 7,0 7,1 7,2 R. Bruce King: Inorganic Chemistry of Main Group Elements, Uitgever: Wiley-VCH ISBN 978-0-471-18602-1
- ↑ 8,0 8,1 8,2 8,3 8,4 Cronyn, Marshall W. (August 2003). The Proper Place for Hydrogen in the Periodic Table. Journal of Chemical Education 80 (8): 947–951. DOI: 10.1021/ed080p947. Gearchiveerd van origineel op 9 oktober 2022.
- ↑ Huheey, J.E.; Keiter, E.A. and Keiter, R.L. (1993) Inorganic Chemistry: Principles of Structure and Reactivity, 4th edition, HarperCollins, New York, USA.
- ↑ James, A.M. and Lord, M.P. (1992) Macmillan's Chemical and Physical Data, Macmillan, London, UK.
- ↑ Redko, M. Y.; Vlassa, M.; Jackson, J. E.; Misiolek, A. W.; Huang, R. H.; Dye, J. L. (2002). "Inverse sodium hydride": a crystalline salt that contains H+ and Na−. Journal of the American Chemical Society 124 (21): 5928–5929. PMID: 12022811. DOI: 10.1021/ja025655+.
- ↑ Sawicka, A.; Skurski, P.; Simons, J. (2003). Inverse Sodium Hydride: A Theoretical Study. J. Am. Chem. Soc. 125 (13): 3954–3958. PMID: 12656631. DOI: 10.1021/ja021136v. Gearchiveerd van origineel op 9 oktober 2022.
- ↑ R. Bruce King: Inorganic Chemistry of Main Group Elements, pag.: 15 Uitgever: Wiley-VCH ISBN 978-0-471-18602-1
- ↑ Wigner, E.; Huntington, H. B. (1935). On the possibility of a metallic modification of hydrogen. Journal of Chemical Physics 3 (12): 764. DOI: 10.1063/1.1749590.
- ↑ Nellis, W. J.; Weir, S. T.; Mitchell, A. C. (1999). Metallization of fluid hydrogen at 140 GPa (1.4 Mbar) by shock compression. Shock Waves 9 (5): 301–305. DOI: 10.1007/s001930050189.
- ↑ 16,0 16,1 16,2 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.), pag.: . Butterworth-Heinemann. ISBN: 978-0-08-037941-8.
- ↑ Cousins, David M.; Davidson, Matthew G.; García-Vivó, Daniel (2013). Unprecedented participation of a four-coordinate hydrogen atom in the cubane core of lithium and sodium phenolates. Chem. Commun. 49 (100): 11809–11811. PMID: 24217230. DOI: 10.1039/c3cc47393g. Geraadpleegd op 7 August 2014.
- ↑ Leach, Mark R.. 2002 Inorganic Chemist's Periodic Table.
- ↑ Sjabloon:Holleman&Wiberg
- ↑ 20,0 20,1 20,2 Stevenson, D. J. (20 november 1975). Does metallic ammonium exist?. Nature 258 (5532): 222–223 (Nature Publishing Group). DOI: 10.1038/258222a0.
- ↑ 21,0 21,1 Bernal, M. J. M.; Massey, H. S. W. (3 February 1954). Metallic Ammonium. Monthly Notices of the Royal Astronomical Society 114 (2): 172–179 (Wiley-Blackwell for the Royal Astronomical Society). DOI: 10.1093/mnras/114.2.172.
- ↑ Solubility Rules!. chem.sc.edu.
- ↑ Reedy, J. H. (1 October 1929). Lecture demonstration of ammonium amalgam. Journal of Chemical Education 6 (10): 1767. DOI: 10.1021/ed006p1767.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.), pag.:812-819. Butterworth-Heinemann. ISBN: 978-0-08-037941-8.
- ↑ 25,0 25,1 R. Bruce King: Inorganic Chemistry of Main Group Elements, pag.: 256 Uitgever: Wiley-VCH ISBN 978-0-471-18602-1
- ↑ Connelly, Neil G.; Geiger, William E. (1996). Chemical Redox Agents for Organometallic Chemistry. Chemical Reviews 96 (2): 877–910. PMID: 11848774. DOI: 10.1021/cr940053x.
- ↑ El Murr, N.; Sheats, J. E.; Geiger, W. E.; Holloway, J. D. L. (1979). Electrochemical Reduction Pathways of the Rhodocenium Ion. Dimerization and Reduction of Rhodocene. Inorg. Chem.]] 18 (6): 1443–1446. DOI: 10.1021/ic50196a007.
- ↑ Keller, H. J.; Wawersik, H. (1967). Spektroskopische Untersuchungen an Komplexverbindungen. VI. EPR-spektren von (C5H5)2Rh und (C5H5)2Ir. J. Organomet. Chem. 8 (1): 185–188. DOI: 10.1016/S0022-328X(00)84718-X.
- ↑ R. Bruce King: Inorganic Chemistry of Main Group Elements, pag.: 226 Uitgever: Wiley-VCH ISBN 978-0-471-18602-1
- ↑ 30,0 30,1 30,2 30,3 R. Bruce King: Inorganic Chemistry of Main Group Elements, pag.: 28 Uitgever: Wiley-VCH ISBN 978-0-471-18602-1
- ↑ Shannon, R. D. (1976). Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides. Acta Crystallogr A 32 (5): 751–767. DOI: 10.1107/S0567739476001551. Gearchiveerd van origineel op 17 March 2020. Geraadpleegd op 4 september 2019.
- ↑ 32,0 32,1 Crookes, William (1864). On Thallium. Journal of the Chemical Society 17: 126 (Harrison & Sons). DOI: 10.1039/js8641700112.
- ↑ 33,0 33,1 Leach, Mark R. (1999–2012). The Internet Database of Periodic Tables. meta-synthesis.com.
- ↑ (2006) The Chemistry of the Actinide and Transactinide Elements (3rd) p. 1729 Uitgever: Springer ISBN 978-1-4020-3555-5
- ↑ Sjabloon:RedBook2005
- ↑ Mudring, Anja-Verena (2007). Thallium Halides – New Aspects of the Stereochemical Activity of Electron Lone Pairs of Heavier Main-Group Elements. Eur. J. Inorg. Chem. 2007 (6): 882–890. DOI: 10.1002/ejic.200600975.
- ↑ Russell AM & Lee KL (2005) Structure-property relations in nonferrous metals. Wiley-Interscience, New York. p. 302. ISBN: 0-471-64952-X
- ↑ Deming HG (1940) Fundamental Chemistry, John Wiley & Sons, New York, pp. 705–7
- ↑ 39,0 39,1 39,2 39,3 Jensen, William B. (2003). The Place of Zinc, Cadmium, and Mercury in the Periodic Table. J. Chem. Education 80 (8): 952–961 (American Chemical Society). DOI: 10.1021/ed080p952. Gearchiveerd van origineel op 11 June 2010. Geraadpleegd op 6 mei 2012.
- ↑ Bailar, J. C. (1973) Comprehensive inorganic chemistry, vol. 3, p. 16. ISBN: 1-57215-291-5
- ↑ 41,0 41,1 41,2 41,3 41,4 41,5 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.), pag.: 1177. Butterworth-Heinemann. ISBN: 978-0-08-037941-8.

















![{\displaystyle {\ce {Co(C5H5)2\ \longrightarrow \ [Co(C5H5)2]^{+}\ +\ e^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/083282810d470b34d6227c101b8b4f7e55cc7b69)







