Basiskennis chemie/Naamgeving/Zouten
Uiterlijk
Naamgeving van zouten
Zouten bestaan uit elektrisch positief en negatief geladen ionen. De naamgeving van zouten is in principe recht toe recht aan: eerst het positieve ion, dan het negatieve ion. Verder is een zout als geheel elektrisch neutraal, dus de formule ervan moet zo zijn dat de totale positieve lading gelijk is aan de totale negatieve lading. Vaak zal het nodig zijn van een of beide ionen meer dan een ion in de formule op te nemen.
Voorbeelden
Hieronder volgen een aantal voorbeelden van bekende en minder bekende verbindingen die allemaal, chemisch gezien, tot de zouten worden gerekend.
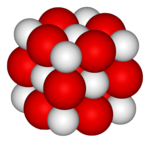
Natriumchloride
De verbinding van natrium en chloride
- In de tabel kun je aflezen dat natrium 1+ ionen vormt, chloor zal als chloride 1- zijn. De naam van de verbinding is: <positief-ion><negatief-ion>, in dit geval dus natriumchloride. In formulevorm: . Dit betekent dat 1 natrium-ion en 1 chloride-ion samen neutraal zijn. In de formule van zouten worden de ladingen van de ionen meestal weggelaten, zodat de formule wordt.
- Dit betekent, omdat in een zoutkristal geen ionen zijn aan te wijzen die echt bij elkaar horen, in een stukje nariumchloride evenveel natrium- als chloride-ionen voorkomen, maar geen moleculen natriumchloride.
- Natriumchloride is vooral bekend als keukenzout, daar is het het voornaamste bestanddeel van. Ook zeezout is voor een groot deel natriumchloride.
- In de figuur hiernaast zijn de chloor-ionen groen en de natriumionen als paarse bolletjes weergegeven. De groene kleur wordt in dit soort modellen vaak voor chloor gebruikt.
Calciumoxide
De verbinding van calcium en oxide
- In de tabel kun je aflezen dat calcium 2+ ionen vormt, zuurstof zal als oxide 2- zijn. De naam van de verbinding is: <positief-ion><negatief-ion>, in dit geval dus calciumoxide. In formulevorm: . Dit betekent dat 1 calcium-ion en 1 oxide-ion samen neutraal zijn. Als de ladingen van de ionen weggelaten worden, wordt de formule .
- Calciumoxide is ook bekend onder de naam ongebluste kalk. Het reageert heftig met water, waarbij zoveel warmte vrijkomt dat het water kan gaan koken. In vroeger tijden werd het ook als cement gebruikt. Tegenwoordig wordt het soms ingezet na rampen om een groot gebied te ontsmetten.
- In de figuur hiernaast zijn de calcium-ionen als witte en de zuurstof-ionen als rode bollen weergegeven. In dergelijke modellen wordt zuurstof heel vaak met rode bollen weergegeven.
IJzer(III)fosfaat
De verbinding van ijzer(III) en fosfaat
- In de tabel kun je aflezen dat ijzer twee- of driewaardige ionen kan vormen. Het Romeinse cijfer III geeft aam dat het in dit geval om de driewaardige variant gaat. In dezelfde tabel kun je vinden dat fosfaat een driewaardig negatief ion is. Een stukje zout dat uit ijzer(III)-ionen en fosfaat-ionen bestaat moet, om elektrisch neutraal te zijn, evenveel ijzer- als fosfaat-ionen voorkomen. De formule is dus: , of zonder de ionladingen: . De naam van de verbinding is: ijzer(III)fosfaat.
De voorgaande voorbeelden gingen steeds over stoffen, waarbij de ladingen van de positieve en de negatieve ionen gelijk zijn. In onderstaande voorbeelden zijn de ladingen van de ionen niet gelijk. Dit zien we vooral terug in de formules van de zouten.
Calciumchloride
De verbinding van calcium en chloor
- In de tabel kun je aflezen dat calcium alleen maar tweewaardige ionen kan vormen. In dezelfde tabel kun je vinden dat chloride een eenwaardig negatief ion is. Een stukje zout dat uit ionen van calcium 2-plus en chloride 1-min bestaat moet, om elektrisch neutraal te zijn, twee keer zoveel chloride-ionen bevatten als calciumionen. De formule is dus: , of zonder de ionladingen: . Omdat calcium maar één soort ionen kan vormen, hoeft in de naam van de verbinding de lading niet vermeld te worden: De naam van de verbinding is: calciumchloride.
- Calciumchloride is een erg hygroscopisch. Als een fles met vast calciumchloride open blijft staan, is na ongeveer 2 weken de hele inhoud opgelost in het water dat uit de lucht is aangetrokken. In het laboratorium wordt calciumchloride gebruikt om water uit olieachtige oplossingen te halen.
Calciumchloride
Calcium met twee chloride-ionen
Calcium met twee chloride-ionen
Natriumcarbonaat
De verbinding van natrium en carbonaat
- In de tabel kun je aflezen dat natrium alleen maar éénwaardige ionen kan vormen. In dezelfde tabel kun je vinden dat carbonaat een tweewaardig negatief ion is. Een stukje zout dat uit ionen van natrium 1-plus en carbonaat 2-min bestaat moet, om elektrisch neutraal te zijn, twee keer zoveel natrium-ionen bevatten als carbonaat-ionen. De formule is dus: , of zonder de ionladingen: . Omdat natrium maar één soort ionen kan vormen, hoeft in de naam van de verbinding de lading niet vermeld te worden: De naam van de verbinding is: natriumcarbonaat.
- Natriumcarbonaat is een bekend zout onder de naam soda. Het wordt als schoonmaak- en ontsmettingsmiddel toegepast.
Ammoniumsulfaat
De verbinding van ammonium en sulfaat
- In de tabel kun je aflezen dat ammonium een éénwaardige samengesteld ion is. In dezelfde tabel kun je ook vinden dat sulfaat een tweewaardig en ook samengesteld negatief ion is. In een stukje zout dat uit ammonium-1-plus en sulfaat 2-min-ionen bestaat moeten, om elektrisch neutraal te zijn, twee keer zoveel ammonium-ionen voorkomen als sulfaat-ionen. De formule is dus: , of zonder de ionladingen: . Om aan te geven dat de atomen in het ammonium-ion bij elkaar horen - en blijven horen - worden ze, als er meer dan één ammonium-ion in het zout nodig is, tussen haakjes gezet. Het aantal keren dat het stuk tussen haakjes in de formule voorkomt staat dan rechtsonder naast de sluithaak.
- De naam van de verbinding is: ammoniumsulfaat.
Chroom(III)sulfaat
De verbinding van chroom(III)] en sulfaat
- In de tabel kun je aflezen dat chroom drie-waardige ionen vormt. In dezelfde tabel kun je vinden dat sulfaat een tweewaardig negatief ion is. In een stukje zout dat uit chroom 3-plus en sulfaat 2-min-ionen bestaat moeten, om elektrisch neutraal te zijn, voor elke twee chroom-ionen drie sulfaat-ionen aanweig zijn. De totale positieve lading is dan 2 * (3+) = 6+, de totale negatieve lading is 3 * (2-) = 6-. Dit betekent dat de netto-lading dan nul is. De formule is dus: , of zonder de ionladingen: . Om aan te geven dat de atomen in het sulfaat-ion bij elkaar horen - en blijven horen - worden ze, als er meer dan een sulfaat-ion in het zout nodig is, tussen haakjes gezet. Het aantal keren dat het stuk tussen haakjes in de formule voorkomt staat dan rechtsonder naast de sluithaak.
- De naam van de verbinding is: chroom(III)sulfaat.