Periodiek systeem/Alkalimetalen, extrapoleren

|
| Empirische (Na - Ce, Mg - Ra) en voorspelde waarden (Fr - Uhp, Ubn - Uhh) voor de atoomstraal, gemeten in Angstrom (=10-10 1 Angstrom = 100 pm) van de alkali- en aardakali-metalen voor de periodes 3 tot en met 9 |

|
| Empirische (Na–Fr) en voorspelde (Uue) waarden voor de elektronaffiniteit van de alkalimetalen in de periodes 3 tot 8, gemeten in eV[2][3] |
|
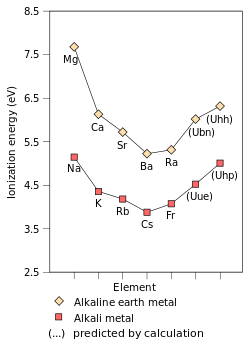
| Empirische (Na - Ce, Mg - Ra) en voorspelde waarden (Fr - Uhp, Ubn - Uhh) voor de ionisatie-energie, gemeten in eV van de alkali- en aardakali-metalen voor de periodes 3 tot en met 9.[2][3] |
Uue
[bewerken]Hoewel francium het zwaarste bekende alkalimetaal is, is er wel al theoretisch werk gedaan aan het voorspellen a la Mendelejev van de chemische en fysische eigenschappen van nu (nog) hypothetische zwaardere alkalimetalen na francium. De zevende periode van het periodiek systeem is met oganesson, element 118 vol. Het volgende element zal een alkalimetaal moeten zijn, met de werknaam ununennium, atoomnummer 119, symbool Uue. Verwacht wordt dat het zich in veel opzichten naar de trend in groep 1 zal gedragen, Maar ook worden een paar duidelijke verschillen met de lichtere alkalimetalen voorspeld.[4] In plaats van een duidelijke voortzetting van de trend via cesium wordt verwacht dat de chemie van dit element veel gelijkenis zal vertonen met die van rubidium[4] of zelfs die van kalium.[5] In voorspellingen die geen rekening houden met relativistische effecten klinkt dat vreemd, in die verwachting zou Uue zelfs nog reactiever moeten zijn dan cesium en francium. De relativistische benadering laat een aantal duidelijke concequenties zien:
- de eerste ionisatie-energie stijgt en
- de atoom- en ionstralen worden kleiner[5]
- de elektronen-affiniteit wordt groter
- de polariseerbaarheid word kleiner[4]
Deze effecten (zie de figuren hiernaast) worden al gezien, zij het minder uitgesproken, bij francium.[4] Een en ander maakt het waarschijnlijk dat Uue zich als een alkali-metaal zal gedragen, maar wel een met duidelijke eigenaardigheden.[6] De elektronen affiniteit wordt waarschijnlijk hoger dan van alle andere alkalimetalen.
De algemene trend van smeltpunten, dalend, wordt waarschijnlijk wel doorgezet, met een verwachte waarde tussen 0 en 30 °C.[7]
De stabilisatie, en daarmee de contractie van de 8s-orbitaal hebben tot gevolg datde atoomstraal slinkt tot 240 pm,[4] heel dicht bij de empirsche waarde van rubidium (247 pm).[8] Op basis hiervan wordt verwacht dat de chemie van Uue veel meer op die van rubidium zal lijken dan op die van francium. Aan de andere kant, de verwachte straal van het -ion is groter dan die van rubidium. De ionstraal wordt vooral bepaald door de uitgebreidheid van de 7p-orbitalen waarvoor een veel kleiner relativistisch effect verwacht wordt dan voor de 8s-elektronen.
Uue zou ook de valentie +3 kunnen vertonen[4] en zelfs +5,[9] oxidatietoestanden die geen enkel alkalimetaal vertoont. Deze extra valenties zijn terug te voeren op een destablisatie die optreedt in de 7p3/2-orbitaal. Dat leidt tot een verlaging van de ionisatie-energie dan verwacht.[10][4]
Ook wordt verwacht dat veel van Uue's verbindingen een covalent karakter zullen hebben ten gevolge van de deelname van 7p3/2 elektronen aan de binding.[11]
Uhe / Uhp
[bewerken]Aan het volgende alkalimetaal is veel minder theoretisch onderzoek gedaan. Het zou element 169 zijn, met de werknaam unhexennium en symbool Uhe. De grote sprong in de atoomnummers is het gevolg van het vullen van de 5g-schil, compleet in lijn met het standaard patroon voor het opvullen van atoomorbitalen met elektronen. Andere berekeningen geven aan dat element 165, unhexpentium, Uhp, een goede kans maakt het alkali-element van periode 9 te zijn. Dirac-Fock-berekeningen leiden tot deze conclusie. Element 165 heeft een elektronenverdeling die geschreven kan worden als .[4][3] Dit element zou de eigenschappen van de groepen 1 en 11 combineren. De fysische en atomaire eigenschappen liggen waarschijnlijk dichter bij de alkalimetalen, de chemische eigenschappen komen waarscijnlijk meer overeen met de kopergroep. Verdere berekeningen geven aan dat de trend van stijgende ionisatie-energie na cesium wordt voortgezet, die wordt vergelijkbaar met die van natrium. Ook de trend rond de dalende atoomstralen na cesium zet door, waarmee de atoomstraal van Uhp in de buurt van die van kalium komt.[4] Een nog niet helemaal onderzocht terrein wordt gevormd door de mogelijkheid dat de 7d-elektronen in reacties deel kunnen nemen, waardoor Uhp hogere oxidatiegetallen kan vertonen dan (+1), waardoor het weer meer op een overgangsmetaaltrekje vertoont.[12][13]
Gegeven het feit dat de alkali- en aardalkalimetalen beide tot het s-blok behoren, zullen voorspellingen die voor Uue en Uhp gedaan worden ook voor de aardalkalimetalen Ubn (element 120, unbinullium) en Uhh (element 166, unhexhexium) gelden.[14]
Ook element 173, (Ust, unseptrium) is nog kandidaat voor het alkali-metaal na Uue met een elektronenconfiguratie van waarmee een typische alkali-structuur ontstaat met 1 vrij los gebonden elektron buiten een gesloten p-schil. Verwacht wordt dat het element reactiever zal zijn dan cesium.[15][16]
De mogelijke eigenschappen van alkalimetalen zwaarder dan Ust zijn tot nu toe (2019) niet onderzocht. Het is zelfs de vraag of ze kunnen bestaan.[3] In periodes 8 en hoger worden de relativistische effecten en schil-interacties zo sterk, dat de vergelijking met elementen in lagere periodes compleet misloopt. Daarnaast speelt mee dat de relativistische en schil-koppelingseffecten (de s-orbitalen stabiliseren, maar de d-, f- en g-orbitalen van de hogere schillen destabiliseren) tegengestelde effecten hebben, waardoor nog grotere verschillen ontstaan tussen relativistische en niet-relativistische berekeningen aan elementen met zulke hoge atoomnummers.[12] De belangstelling voor de chemische eigenschappen van de elementen ununennium, unhexpentium en unsepttrium berust op het feit dat zij dicht liggen bij de plek van eilanden van stabiliteit die verwacht worden bij de elementen 122 en 164 .[17][18][19]
| 1 | 18 | |||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | H | 2 | 13 | 14 | 15 | 16 | 17 | He | ||||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||||||||||
| 5 | Rb | Sr | f - blok | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||||||||||
| 7 | Fr | Ra | g - blok | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||||||||
| 8 | 119 | 120 | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | 143 | 144 | 145 | 146 | 147 | 148 | 149 | 150 | 151 | 152 | 153 | 154 | 155 | 156 | 157 | 158 | 159 | 160 | 161 | 162 | 163 | 164 | 165 | 166 | 167 | 168 |
| 9 | 169 | 170 | 171 | 172 | 173 | 174 | 175 | 176 | 177 | 178 | 179 | 180 | 181 | 182 | 183 | 184 | 185 | 186 | 187 | 188 | 189 | 190 | 191 | 192 | 193 | 194 | 195 | 196 | 197 | 198 | 199 | 200 | 201 | 202 | 203 | 204 | 205 | 206 | 207 | 208 | 209 | 210 | 211 | 212 | 213 | 214 | 215 | 216 | 217 | 218 |
- ↑ Deze pagina is een vertaling van de tekst in het lemma Alkali metal op de Engelstalige Wikipedia, paragraaf "Extensions" zoals deze op 2 juli 2023 aanwezig was.
- ↑ 2,0 2,1 (2006) The Chemistry of the Actinide and Transactinide Elements (3rd) p. 1730 Uitgever: Springer ISBN 978-1-4020-3555-5
- ↑ 3,0 3,1 3,2 3,3 Pyykkö, Pekka (2011). A suggested periodic table up to Z ≤ 172, based on Dirac–Fock calculations on atoms and ions. Physical Chemistry Chemical Physics 13 (1): 161–8. PMID: 20967377. DOI: 10.1039/c0cp01575j.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 4,7 4,8 (2006) The Chemistry of the Actinide and Transactinide Elements (3rd) p. 1729 Uitgever: Springer ISBN 978-1-4020-3555-5
- ↑ 5,0 5,1 Seaborg, G. T. (c. 2006). "transuranium element (chemical element)". Encyclopædia Britannica. Retrieved 16 March 2010.
- ↑ Gäggeler, Heinz W. (5–7 November 2007). Gas Phase Chemistry of Superheavy Elements. Lecture Course Texas A&M.
- ↑ (2006) The Chemistry of the Actinide and Transactinide Elements (3rd) Uitgever: Springer ISBN 978-1-4020-3555-5
- ↑ Royal Society of Chemistry. Visual Elements: Group 1 – The Alkali Metals. Visual Elements. Royal Society of Chemistry.
- ↑ Cao, Chang-Su; Hu, Han-Shi; Schwarz, W. H. Eugen; Li, Jun (2022). Periodic Law of Chemistry Overturns for Superheavy Elements. ChemRxiv. DOI: 10.26434/chemrxiv-2022-l798p. Geraadpleegd op 16 november 2022.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.), pag.: 28. Butterworth-Heinemann. ISBN: 978-0-08-037941-8.
- ↑ Thayer, John S. (2010). Relativistic Effects and the Chemistry of the Heavier Main Group Elements. Relativistic Methods for Chemists Challenges and Advances in Computational Chemistry and Physics 10: 81, 84. DOI: 10.1007/978-1-4020-9975-5_2.. ISBN: 978-1-4020-9974-8.
- ↑ 12,0 12,1 (2006) The Chemistry of the Actinide and Transactinide Elements (3rd) p. 1732 Uitgever: Springer ISBN 978-1-4020-3555-5
- ↑ Fricke, Burkhard (1975). Superheavy elements: a prediction of their chemical and physical properties. Recent Impact of Physics on Inorganic Chemistry Structure and Bonding 21: 89–144. DOI: 10.1007/BFb0116498. Geraadpleegd op 4 October 2013.. ISBN: 978-3-540-07109-9.
- ↑ (2006) The Chemistry of the Actinide and Transactinide Elements (3rd) p. 1729-1733 Uitgever: Springer ISBN 978-1-4020-3555-5
- ↑ Fricke, Burkhard (1977). Dirac-Fock-Slater calculations for the elements Z = 100, fermium, to Z = 173. Recent Impact of Physics on Inorganic Chemistry 19: 83–192. DOI: 10.1016/0092-640X(77)90010-9. Gearchiveerd van origineel op 22 March 2016. Geraadpleegd op 25 February 2016.
- ↑ Kul'sha, A. V.. Есть ли граница у таблицы Менделеева? (in ru).
- ↑ Kratz, J. V. (5 September 2011). The Impact of Superheavy Elements on the Chemical and Physical Sciences (PDF). 4th International Conference on the Chemistry and Physics of the Transactinide Elements. Archived (PDF) from the original on 9 October 2022. Retrieved 27 August 2013.
- ↑ Nuclear scientists eye future landfall on a second 'island of stability'. EurekAlert! (2008-04-06). Retrieved on 2016-11-25.
- ↑ Grumann, Jens; Mosel, Ulrich; Fink, Bernd; Greiner, Walter (1969). Investigation of the stability of superheavy nuclei around Z=114 and Z=164. Zeitschrift für Physik 228 (5): 371–386. DOI: 10.1007/BF01406719.


![{\displaystyle {\ce {[Og] 5g^{18}\, 6f^{14}\, 7d^{10}\, 8s^{2}\,8p_{1 \, / \,2}^{2}\,9s^{1}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/245480df89755a30fb94d49b1d8d929afe4cd370)
![{\displaystyle {\ce {[Usb] \ 6g^{1}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fbfc593494ac935d72628031f1fb05ddee395a98)

