Alkenen
In het vorige boek zijn een aantal verbindingen van
koolstof met waterstof besproken. De binding tussen de verschillende atomen in een molecuul werden daarin verzorgd door steeds twee elektronen die om beide atoomkernen draaiden. Het blijkt dat het ook mogelijk is dat er vier (
of zelfs 6) elektronen om twee atoomkernen kunnen bewegen. In deze paragraaf kijken we vooral naar verbindingen waarin een of meer van de koppelingen tussen atomen door 4 elektronen verzorgd worden. Omdat het aantal elektronen twee keer zo groot is als normaal, wordt zo'n binding een
dubbele binding genoemd. Als duidelijk onderscheid wordt een binding die door twee elektronen verzorgd wordt, een
enkele binding genoemd.
Dubbele binding
Er wordt in een keten koolstofatomen van twee daarvan een extra binding gebruikt om de koolstofatomen aan elkaar te binden. Dat betekent dat er twee (op elk koolstofatoom één) waterstofatomen minder in het molecuul zitten. De verbinding bevat niet alle waterstofatomen die eigenlijk bij het aantal koolstofatomen hoort. In vergelijking met een alkaan kan de verbinding er nog meer hebben, en wordt daarom onverzadigd genoemd. Alkanen kunnen niet meer waterstofatomen naast het aantal koolstofatomen bevatten, deze verbindingen worden verzadigd genoemd.
Verzadigde verbinding
Onverzadigde verbinding
De naamgeving van verbindingen die ook een dubbele binding in hun molecuul bevatten verloopt parallel aan die van de alkanen. Er is één belangrijk verschil: de dubbele binding zit altijd in de stamnaam, zelfs als er een langere keten in het molecuul te vinden is (waar dan niet de dubbele binding in zit). De naam wordt gevormd door de uitgang ~aan te vervangen door ~een.
Naam
Bij bovenstaande formules kunnen de volgende opmerkingen gemaakt worden:
- Om de plek van de dubbele band aan te geven worden, net als bij de substituenten aan alkanen, nummers gebruikt. Omdat de dubbele band altijd in de hoofdketen ligt, is het voldoende om aan te geven waar de dubbele band begint. Hij gaat vanzelf naar het volgende koolstofatoom.
- De nummers worden direct voor de uitgang ~een gezet.
- Komen er meerdere dubbele banden in een molecuul voor dan wordt het aantal aangegeven met de Griekse telwoorden.
- Als het nodig is, wordt de nummering van de hoofdketen zo gekozen dat de dubbele band een zo laag mogelijk nummer krijgt.
- Bij cyclische verbindingen (voorbeeld 4 en 5) krijgt een van de koolstofatomen van de dubbele band nummer 1, het koolstofatoom van dezelfde dubbele band krijgt nummer 2, en zo nummer je door de ring. Je nummert op zo'n manier dat je voor de dubbele-band-posities zo laag mogelijke nummers gebruikt. Voor verbinding 4 hierboven zou je ook cyclohexa-1,5-dieen kunnen noteren, maar dan zijn de plaatsnummers niet zo laag mogelijk.
Plaatsnummers
Net als voor de alkanen geldt er voor de alkenen een algemene formule. Voor de
alkanen was dat:

Het feit dat er een dubbele binding bij een koolstofatoom zit, betekent dat er een plaats minder is om een waterstofatoom te binden. De geldt voor beide koolstofatomen van de dubbele binding. In het molecuul als geheel zijn er dus per dubbele binding twee waterstofatomen minder! Voor een alkeen als in de voorbeelden 1 en 2 betekent dit dat de algemene formule geschreven wordt als:

In voorbeeld 3 is er een extra dubbele band in het molecuul aanwezig, dus kost dat nog twee waterstofatomen. De algemene formule wordt:

In de voorbeelden 4 en 5 is ook een ring aanwezig. Deze
kost ook weer twee waterstofatomen.
Algemene formule alkenen
Ruimtelijke structuur van alkenen
In vergelijking met de alkanen is er een aantal aspecten van de ruimtelijke structuur die bij alkenen afwijken:
- In tegenstelling tot de enkele binding bij de alkanen is de dubbele binding bij de alkenen niet draaibaar.
- De ruimtelijke structuur van het alkaan heeft plaatsgemaakt voor een platte structuur: Alle atomen van en direct aan de dubbele binding liggen in één plat vlak.
- De hoek tussen de bindingen is ongeveer 120°.
Ruimtelijke structuur
Bij etheen is het nog niet echt duidelijk, bij
but-2-een wordt een eigenaardigheid van de dubbele band duidelijk zichtbaar:
|
|

|
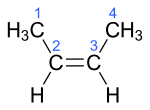
|
| Officieel |
2E-but-2-een |
2Z-but-2-een
|
| Oud |
trans-but-2-een |
cis-but-2-een
|
E/Z-isomerie
In het linker molecuul bevinden de twee methyl-groepen zich aan verschillende kanten van de dubbele binding, in het rechter molecuul zitten ze aan dezelfde kant van de dubbele band. Nu is belangrijk dat er geen draaiing mogelijk is om die dubbele band. Dat betekent ook dat, in tegenstelling tot de alkanen met hun vrije draaibaarheid, deze twee moleculen echt twee verschillende stoffen zijn.
Om de twee stoffen van elkaar te onderscheiden worden de aanduidingen E (uit het Duits: Entgegen) en Z (ook uit het Duits: Zusammen) gebruikt. Bovendien wordt, als er meer dubbele banden in het molecuul zitten, ook de plaats aangegeven waar de aanduiding bij hoort.
Deze eigenschap van alkenen was uiteraard al heel lang bekend, en vroeger werd voor de aanduiding
E de term
trans gebruikt,
Z werd toen
cis genoemd. Dit leverde echter problemen op toen nieuwe verbindingen werden gevonden.
Dubbele binding equivalent
Zoals je hierboven gezien hebt, zijn er steeds twee waterstofatomen minder in het molecuul voor elke dubbele binding of ring. Samen worden deze structuurelementen "dubbele binding equivalenten" genoemd. Voor het bepalen van de algemene formule van een verbinding geldt nu:

Dubbele binding equivalent
DBE
Reacties van alkenen
De reacties van alkenen kunnen in twee groepen verdeeld worden: De reacties die ook op kunnen treden bij de alkanen, en reacties die specifiek zijn voor de dubbele band.
Reacties van alkenen
Reacties als alkanen
Alkenen vertonen de verschillende reacties die ook voor alkanen gelden. Zo reageren ze met zuurstof waarbij alleen
kooldioxide en water overblijven, bijvoorbeeld
propeen::

of de reactie van chloorgas met propeen, waarbij 3-chloorpropeen ontstaat (en Waterstofchloride)
![{\displaystyle {\ce {CH3-CH=CH2\ +\ Cl2\ ->[{\ce {~500^{o}C}}][{\ce {\ }}]\ ClCH2-CH=CH2\ +\ HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2d6325cc905eae6626f6ab61596f766563e36beb)
Reacties niet aan de dubbele band
Reacties van alkenen aan de dubbele band
Daarnaast vertonen alkenen een aantal reacties de specifiek zijn voor de dubbele band.
Dubbele band reacties
Reacties van alkenen met waterstof
Alkenen reageren onder invloed van een katalysator met
waterstofgas.
![{\displaystyle {\ce {R2C=CR2\ +\ H2\ ->[{\ce {katalysator}}][{\ce {\ }}]\ R2CH-CHR2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fd69929ff452a0bda2ad4253a2239a3b8327b069)
In bovenstaande reactievergelijking staan de letters R voor (mogelijk verschillende) willekeurige atomen of atoomgroepen. In onderstaande figuur is de reactie nogmaals weergegeven, het blauwe blok is de katalysator:
Hydrogeneren
Reacties van alkenen met halogenen
Alkenen reageren met de
halogenen,
fluor,
chloor,
broom en
jood. Afhankelijk van het halogeen verloopt de reactie explosief (fluor) tot eigenlijk alleen onder invloed van een katalysator en zelfs dan nog traag (jood).

Halogenen worden in de organische chemie in reactievergelijkingen (als het niet belangrijk is welk halogeen het precies is) vaak met een X aangegeven. In onderstaande figuur is de reactie nogmaals weergegeven, waarbij alle R-groepen bestaan uit een enkel waterstofatoom en chloor het halogeen is:
Halogeneren
Alkenen reageren met halogenen zowel aan de dubbele bad als aan het verzadigde deel van het molecuul. Aan de dubbele band wordt de reactie doorgaans uitgevoerd in een oplosmiddel. Dat betekent ook bij een veel lagere temperatuur dan die voor de reactie aan het verzadigde deel van het molecuul nodig is.
Halogeneren dubbele band t.o.v. verzadigde deel
Reacties van alkenen met waterstofhalogenides
Etheen reageert met de waterstofhalogeniden (

) onder vorming van respectivelijk
fluorethaan,
chloorethaan,
broomethaan of
joodethaan:

Hydrohalogeneren
Polymerisatiereacties van alkenen
Technisch en economische is de polymerisatiereactie van alkenen veruit de belangrijkste reactie. Onder geschikte omstandigheden (warmte, katalysator) kan de dubbele binding "openklappen". Elk koolstofatoom heeft nu een vrije bindingsplaats met één elektron. Zo'n koolstofatoom kan reageren met de dubbele binding in een ander molecuul. Die binding "klapt ook open" en een van de koolstofatomen bindt met een van de koolstofatomen van het eerste opengeklapte molecuul. Er ontstaat een molecuul met vier koolstofatomen met aan beide uiteinden een koolstofatoom met een vrije bindingsmogelijkheid. De reactie tussen een koolstofatoom met een vrije binding en een alkeen-molecuul herhaalt zich een groot aantal keren, tot toevallig twee koolstofatomen met een vrije binding elkaar tegenkomen. Onderstaande figuur geeft een voorbeeld van de vorming van een polymeer uit etheen:
Polymeriseren
Alkeenpolymeren
Veel polymeren ken ken je ook uit het dagelijks leven. In onderstaande tabel staan er een aantal vermeld met het monomeer (het alkeen waaruit ze ontstaan):
Hieronder staat een model van PVC
Voorbeelden van polymeriseren






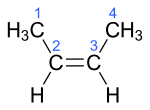














![{\displaystyle {\ce {CH3-CH=CH2\ +\ Cl2\ ->[{\ce {~500^{o}C}}][{\ce {\ }}]\ ClCH2-CH=CH2\ +\ HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2d6325cc905eae6626f6ab61596f766563e36beb)
![{\displaystyle {\ce {R2C=CR2\ +\ H2\ ->[{\ce {katalysator}}][{\ce {\ }}]\ R2CH-CHR2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fd69929ff452a0bda2ad4253a2239a3b8327b069)






