Periodiek systeem/Stikstofgroep, organo-elementverbindingen ER3
3 organische liganden[Bron 1]
Naamgeving
[bewerken]De naamgeving van deze groep verbindingen kan verwarrend zijn.
- In het verlengde van de benaming "amine" en fosfine, wordt achter de naam van het element de uitgang ~ine toegevoegd. Als substituerende groepen worden vervolgens de verschillende organische resten, in alfabetische volorde, eventueel met gebruik van de Griekse telwoorden als er meer dan 1 keer dezelfde groep voorkomt, als voorvoegsels voor de naam van het element geplaatst. Als voorbeeld, krijgt de naam ethyldimethylarsine.
- Daarnaast is er de naamgeving van de IUPAC, waarin de verschillende verbindingen met de elementnaam met als toevoeging ~aan worden benoemd: het hierbioven genoemde vorobeeld wordt dan ethyldimethylarsaan.
Hier zal de eerste systematiek gevolgd worden, bij verwijzen naar de Wikiprdia kan dus soms de verbinding een naam hebbem die op ~aan eidigt.
Algemene opmerking
[bewerken]De stikstofgroep beschikt zelf over 5 elektronen in de valentieschil, er zijn er dus drie nodig om deze tot een octet aan te vullen. Drie organische groepen zijn hiervoor voldoende.
Synthese
[bewerken]Van alle leden van de stikstofgroep, met uitzondering van moscovium, zijn verbindingen bekend met één, twee of drie organische substituenten. Het aantal wordt vooral bepaald door de verhouding waarin de uitgangsstoffen gemengd worden. De manieren om de synthese van deze verbindinegn te realiseren zijn even divers als de elementen uit de stikstofgroep zelf.
Stikstof
[bewerken]Voor de amines is de uitgangsstof voor kleine hoeveelheden doorgaans ammoniak dat met een organisch halogenide reageert:
Het ontstane methylamine kan verder reageren als er een overmaat chloormethaan aanwezig is tot dimethylamine en trimethylamine:
- en bij een nog grotere overmaat:
- .
Industriel wordt trimethylamine voornamelijk geproduceerd door de reactie van ammoniak met methanol:[1]
Hierbij worden ook water, methylamine en dimethylamine gevormd. Het mengsel wordt in meerdere destillatiestappen gescheiden.
Fosfor
[bewerken]Voor organofosforverbindingen is een driewaardige fosforverbinding de uitgangsstof. Daarin zijn aan fosfor substituenten gekoppeld die relatief makkelijk als anion [w:Leaving group|leaving group]] kunnen zijn. Voor trimethylfosfine wordt de reactie tussentrifenylfosfiet en methylmagnesiumchloride gebruikt:[2]
Voor trifenylfosfine wordt op laboratoriumschaal gebruik gemaakt van fosfortrichloride en w:Fenyllithium of fenylmagnesiumbromide:
Ook is reductie van trifenylfosinoxide mogelkijk met truchloorsilaan
Op industriële schaal wordt gebruik gemaakt van de reductieve koppeling van fosfortrichloride en chloorbenzeen met natrium als reducerend reagens:

Een speciale groep stoffen waarin fosfor met drie bindingen aan koolstof gekoppeld is, wordt gevormd door de fosfa-alkynen, derivaten van ethyn waarin een fosfor-atoom de plaats heeft ingenomen van een van de koolstof-atomen. Zowel gesubstitueerde als de stamverbinding van deze groep zijn beschreven. Als voorbeeld hiernaast: tert-Butylfosfa-acetyleen]
Arseen
[bewerken]Ook hier is een driewaardige verbinding , nu van arseen, uitgangsstof voor de synthese. Voor trimethylarsine wordt arseen(III)oxide als arseenbron en trimethylaluminium:[Noot 2]
De synthese van het fenylderivaat is een reductieve koppeling van twee chlorides met natrium als reductor:[3]
Antimoon
[bewerken]Ook voor trimethylantimoon wordt gebruik gemaakt van de route via een antimoon(III)verbinding en een methylgroep gekoppeld aan een relatief elektropositief element:[4][5]
Het opmerkelijke aan de tweede synthese is het feit dat de reactie in water kan worden uitgevoerd. Antimoon, vaak omschreven als metaloide, is blijkbaar nog voldoende niet-metaal om de hydrolyse te kunnen weerstaan.
Daarnaast is het ook mogelijk het te reduceren met lithiuboorhydride of lithiumaluminiumhydride naar de trimethylverbinding.[6]
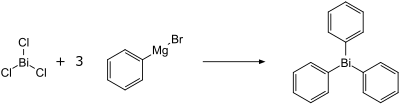
Bismut
[bewerken]Trimetylbismutine wordt gesynthetiseerd uit bismut(III)chloride en methyllithium.:
Op analoge wijze kan ook de synthese van trifenylbismutaan gerealiseerd worden, het reagens is nu fenyllithium[7] of fenylmagnesiumbromide.[8][9]
Reacties
[bewerken]Met H+ als zuur
[bewerken]De verbindingen van het type beschikken allemaal over een vrij elektronenpaar. Op afbeeldingen van molecuulmodellen staat dit vrije paar ook netjes aangegeven, klaar om in een zuur-base-reactie gebruikt te gaan worden. Hoewel het paar wel in principe beschikbaar is, wil dat niet zeggen dat de bereikbaarheid ook steeds optimaal is. Dit blijkt ook uit de structuurgegevens: de hoek C-E-C is voor alle (stikstof uitgezonderd) veel kleiner dan de 107° van de tetraeder, en gaat naar de hogere leden van de groep steeds meer naar de 90°, de hoek voor pure p-orbitalen. Daarmee wordt aangegeven dat voor deze elementen er nauwelijks hybridisatie met de s-orbitaal optreeedt.

|

|
||||
Behalve voor stikstof (in de vorm van de amines) en in iets mindere mate voor de fosfines, waarvan zouten van het type bekend zijn, geldt dat de basische eigenschappen van de verbindingen ten opzichte van waterstof klein zijn. De oplosbaarheid van de verschillende trimethylverbindingen in aangezuurd water is, weer met uitzondering van de twee lichtste leden van de stikstofgroep, klein.
De opmerking dat stikstof een uitzondering is wat betreft de affiniteit van het vrije elektronenpaar voor heeft alleen betrekking op de alkyl-gesubstitueerde amines. In het geval van aryl-gesubstitueerde amines blijkt een heel ander verhaal zoals uit onderstaande tabel blijkt:
| aantal | ||
|---|---|---|
| 0 | 9,24[10] | 9,24[10] |
| 1 | 10,26[11] | 4,63[12] |
| 2 | 10,71[13] | 0,79[14] |
| 3 | 9,81[15] | -5(!)[16] |
In de kolom van de methylamines, blijven de waarden niet iets basisch van neutraal. Er is een lichte toename van de pKz gaande van ammoniak via het monomethyl- naar het dimethylamine, om vervolgens weer iets af te nemen. Dit is in overeenstemming met het gegeven in de organische chemie dat alkylgroepen een positieve lading stabiliseren. De hogere pKz-waarde geeft aan dat het waterstof-ion pas bij een hogere pH wordt afgestaan, dus hechter aan de rest van het molecuul gebonmden is. De weer dalende pKz vaar de trimetylverbinding kan samenhangen met de slechtere oplosbaarheid in water van de steeds groter wordende organische groep van het molecuul.
Bij de aromatische amines is duidelijk iets anders aan de hand. De pKz neemt met grote sprongen af om bij de trifenylverbinding bij -5 te eindigen. De steeds lagere pKz-waarde betekent dat naarmate het aantal fenylgroepen groter wordt, het waterstof-ion minder sterk gebonden is. Met drie fenylringen lukt het alleen in zeer sterk zuur milieu een waterstof-ion op het molecuul te drukken. In normale waterige oplossingen komen in de praktijk geen trifenylammonium-ionen voor.
De verklaring voor het verschi tussen de alkyl- en aryl-verbindingen kan volledig gevonden worden in het verschil in hybridisatie van het stikstof-atoom. In de alkyl-verbindingen is een sp3-gehybroidiseerd stikstof-atoom aanwezig met een duidelijk vrije elektronenpaar dat vrij de ruimte insteekt. In de aromatische amines is het vrije elektronenpaar op stikstof niet meer een onderdeel van een sp3-systeem, maar, met het stijgend aantal fenylgroepen, steeds meer een sp2-karakter krijgt en onderdeel wordt van het geconjugeerde aromatische systeem van de fenylringen. Zoals in onderstaande figuur is te zien kunnen de elektronen in het geconjugeerde systeem zo verdeeld worden dat er een positieve lading op stikstof ontstaat, terwijl de negatieve lading over de drie fenylringen wordt verdeeld.[Noot 3] Het stikstof-atoom heeft daardoor nauwelijks de mogelijkheid om een waterstof-ion te binden.

H+ als oxidator
[bewerken]Hoewel door de moeilijke bereikbaarheid van het vrije elektronenpaar de koppeling tussen en het element minder waarschijnlijk wordt, ontsnapt het ysteem soms op een andere manier, zoals in het geval van de antimoonverbinding: waterstof treedt op als oxidator:
Met RX
[bewerken]Hoewel bij de bespreking van de reacties van amines t5ijdens een eerste kennismaking met deze groep verbindingen vaak reactie 1 wordt genoemd, verloopt de technische bereiding van tetramethylammoniumverbindingen volgens reactie 2:
Voor de overige elementen is vooral de laboratoriumreactie belangrijk, en worden vooral variaties op reactie 1 gebruikt:
Met X2
[bewerken]Verschillende, maar niet alle, verbindingen uit deze reeks reageren met (soms verstopte) dihalogenen, waarbij verbindingen van het type (CH3)3EX2</chem> gevormd worden:
Met O2 en S
[bewerken]Met zuurstof of oxidatoren die per saldo zuurdtof leveren, worden oxides gevormd, waarbij het cerntrale element naar oxidatiegetgal +5 gaat.
Met metalen
[bewerken]Met Lewiszuren
[bewerken]Met overgangsmetalen
[bewerken]Voor de overgangsmetalen zijn veel van de trialkyl-verbindingen goede liganden.
Overzicht van E(CH3)3 en E(C6H5)3 verbindingen
[bewerken]| Element | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Formule | Smpnt[· 1] | Kkpnt[· 2] | pKz[· 3] | pow[· 4] | Formule | Smpnt[· 1] | Kkpnt[· 2] | pKz[· 3] | pow[· 4] | |
| Stikstof | N(CH3)3 | -118 | 3 | 9,81 | 0,119 | N(C6H5)3 | 127 | 348 | -5(!) | 5,74 |
| Fosfor | P(CH3)3 | -86 | 38-40 | 8,65 | P(C6H5)3 | 81,5 | 377 | |||
| Arseen | As(CH3)3 | -87 | 56 | [· 5] | As(C6H5)3 | 61 | ||||
| Antimoon | Sb(CH3)3 | -62 | 81 | [· 5][· 6] | Sb(C6H5)3 | 54 | 377 | |||
| Bismut | Bi(CH3)3 | -85,9[20] | 110[20] | [· 5] | Bi(C6H5)3 | 78 | 242 | |||
- ↑ 1,0 1,1 Smpnt: Smeltpunt in °C
- ↑ 2,0 2,1 Kkpnt: Kookpunt in °C
- ↑ 3,0 3,1 pKz voor de reactie . Hoe groter pKz des te sterker is de base.
- ↑ 4,0 4,1 pow: , hoe hoger deze waarde, hoe beter de stof oplost in vetten en des te slechter in water.
- ↑ 5,0 5,1 5,2 De oplosbaarheid van de neutrale verbinding in water is minimaal. Op grond van het steeds inerter worden van het vrije elektronenpaar met het stijgen van het atoomnummer is de base-sterkte steeds kleiner en het getalsmatig meten steeds moeilijker.
- ↑ is een zwakkere base dan
Deze verbindingen zijn allemaal basen, al varieert de sterkte.
Bronnen
- ↑ De gegevens voor deze pagina zijn ontleend aan de verschillende pagina's voor de besproken verbindingen op de Nederlandse, Engelse en Duitstalige Wikipedia in de periode 5 tot 25 maart 2024
Noten in de telkst
- ↑ Het siliciumhoudende product in deze reactie vormt een polymeer, een op moleculair niveau kloppende reactievergelijking is dus alleen op deze manier te schrijven.
- ↑ Trimethylaluminium vormt dimeren en wordt dus als genoteerd.
- ↑ Strikt genomen wordt de lading nog meer uitgespreid: ook de ortho-posities ten opzichte van de binding naar stikstof zullen een deel van de lading dragen. De ontrekking van elektronen is dus groter dan de figuur suggereert.
Verwijzingen in de telkst
- ↑ A.B. van Gysel & W. Musin - Methylamines, Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim
- ↑ (1990) Trimethylphosphine ISBN 978-0-470-13259-3
- ↑ Shriner, R. L.; Wolf, C. N. (1963). "Tetraphenylarsonium Chloride Hydrochloride". Organic Syntheses; Collected Volumes, vol. 4, p. 910.
- ↑ Hermann Kolbe: Ausführliches Lehrbuch der organischen Chemie : in drei Bänden : Bd. 3, Abth. 1 : / bearb. von E. von Meyer u. A. Weddige. In: Graham-Otto's ausführliches Lehrbuch der Chemie. 4. Auflage. Vieweg, Braunschweig 1878
- ↑ Richard Müller, Christian Dathe. (mei 1966). Über Silikone, CVI. Darstellung von Organoantimon(III)- und Organobismutin(III)-Verbindungen mit Hilfe von Organopentafluorosilicaten bzw. Organotrifluorsilanen in wäßriger Lösung. Chemische Berichte. 99 (5): 1609–1613 DOI:10.1002/cber.19660990527
- ↑ Egon Wiberg, Kurt Mödritzer. (december 1956). Notizen: Über die Hydrierung von Halogenverbindungen der 5. Hauptgruppe: II. Zur Frage der Existenz eines Antimon(V)-wasserstoffs SbH5. Zeitschrift für Naturforschung B. 11 (12): 748–750 DOI:10.1515/znb-1956-1212
- ↑ Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3. umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1978, ISBN: 3-432-87823-0, S. 601.
- ↑ Citefout: Onjuist label
<ref>; er is geen tekst opgegeven voor referenties met de naameEROS - ↑ Blicke, F.F.; Oakdale, U.O.; Smith, F.D.: Distibyls. I. Tetraphenyldistibyl. Attempts to Obtain Tetraphenyldibismuthyl in J. Am. Chem. Soc. 53 (1931) S. 1025–1029, doi:10.1021/ja01354a027.
- ↑ 10,0 10,1 Ammoniak op Wikipedia (18 maart 2024)
- ↑ Methylamine op Wikipedia (18 maart 2024)
- ↑ Aniline op Wikipedia (18 maart 2024)
- ↑ Methylamine op Wikipedia (18 maart 2024)
- ↑ Difenylamine op Wikipedia (18 maart 2024)
- ↑ Trimethylamine op Wikipedia (18 maart 2024)
- ↑ Trifenylamine op Wikipedia (18 maart 2024)
- ↑ 17,0 17,1 17,2 17,3 17,4 17,5 17,6 Christoph Elschenbroich. Organometallchemie. (6e herziene editie ed.) 207–208 – (Wiesbaden) ISBN: 978-3-8351-0167-8
- ↑ Mitschke, Karl-Heinz (November 1973). Pentamethylarsen. Chemische Berichte 106 (11): 3645–3651. DOI: 10.1002/cber.19731061124.
- ↑ Beauchamp, A. L.; Bennett, Michael J.; Cotton, F. Albert (November 1968). A reinvestigation of the crystal and molecular structure of pentaphenylantimony. Journal of the American Chemical Society 90 (24): 6675–6680. DOI: 10.1021/ja01026a020.
- ↑ 20,0 20,1 Chemicalbook














![{\displaystyle {\ce {SbF3\ +\ 3(NH4)2[CH3SiF5]\ ->[{\ce {H2O}}]\ Sb(CH3)3\ +\ 3(NH4)2SiF6}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/993c355d4fab6294cb8844721c24d9f5614addab)








![{\displaystyle {\ce {[HP(CH3)3^{+}]X^{-}\ \ \ (X\ =\ Cl,\ Br,\ I)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/020e7bbb49705c1d7c99e73ea35b3062cdee5786)





![{\displaystyle {\ce {N(CH3)3\ +\ CH3X\ ->\ [N(CH3)4^{+}]X\ \ \ \ \ X\ =\ Cl,\ Br,\ I}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8c1eb7892fcf4fd81d6076b17106a8e865702a2c)
![{\displaystyle {\ce {NH4Cl \ + \ 2 (CH3)2CO3 \ -> \ [N(CH3)4]Cl \ + \ 2 H2O \ + \ 2 CO2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a51b49780046e045654dfb7ed5a71aa90beb4381)
![{\displaystyle {\ce {P(CH3)3\ +\ CH3Br\ ->\ [P(CH3)4^{+}]Br^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c6703e88b3468a4284b5008825b90006c9ad2b0b)
![{\displaystyle {\ce {Sb(CH3)3\ +\ CH3I\ ->\ [Sb(CH3)4^{+}]I^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a860031b96088a295550debdde64cd2e5b52fa08)




![{\displaystyle {\ce {(C4H8O)N(CH3)\ +\ H2O2\ ->[{\ce {75^{o}C}}]\ (C4H8O)N(O)(CH3)\ +\ H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f810b4cb646fe22fc5dbe0e386f9445f1a5bade7)










![{\displaystyle log\left({\frac {[stof_{octanol}]}{[stof_{water}]}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2c8c3dcc3e1529855a44619e6b9473bce4e3ba79)
