Basiskennis chemie 3/Zuur volgens Brønsted en Lowry
Uiterlijk
Zuur volgens Brønsted
Al eerder heb je kennisgemaakt met het begrip "zuur": een deeltje dat H+ kan afstaan. Verder is azijnzuur veel als voorbeeld van een zuur gebruikt.
De definitie "H+ kunnen afstaan" is afkomstig van de de Deense chemicus Brønsted. Naast azijnzuur zijn er nog een groot aantal andere stoffen die H+ kunnen afstaan. In tabel 49 van BINAS kun je er een aantal vinden.
De definitie "H+ kunnen afstaan" is afkomstig van de de Deense chemicus Brønsted. Naast azijnzuur zijn er nog een groot aantal andere stoffen die H+ kunnen afstaan. In tabel 49 van BINAS kun je er een aantal vinden.
Meerwaardige zuren
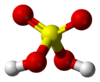
Zuren die meer dan één H+ kunnen afstaan worden meerwaardige zuren genoemd. Voorbeelden zijn: zwavelzuur dat twee H+-ionen kan afstaan en fosforzuur dat er zelfs 3 kan afstaan. Wat wel voor deze zuren geldt is dat het afstaan van de waterstof-ionen niet tegelijk gaat. In een oplossing van zwavelzuur in water zullen eerst (bijna) alle zwavelzuur-moleculen 1 waterstof-ion afstaan. Pas als er vrijwel geen moleculen meer over zijn, er is dan wel een heleboel waterstofsulfaat () gevormd, zullen de eerste -ionen hun afstaan en sulfaat, , vormen.
Base, geconjugeerde base, geconjugeerd zuur
Door Brønsted is ook het begrip "base" gedefinieerd: Een base is een deeltje dat -ionen kan opnemen. In de voorbeelden met azijnzuur en acetaat is het laatste deeltje duidelijk een base: het kan een opnemen (en wordt dan azijnzuur). Een base die op deze manier bij een zuur hoort, de base heeft 1 minder, wordt de geconjugeerde base van het zuur genoemd.
- Acetaat is de geconjugeerde base van azijnzuur
Omgekeerd, een zuur dat op vergelijkbase manier bij een base hoort, het zuur heeft 1 meer dan de base, wordt het geconjugeerde zuur van de base genoemd.
- Azijnzuur is het geconjugeerde zuur van acetaat
Base
Geconjugeerde base
Geconjugeerd zuur
Geconjugeerde base
Geconjugeerd zuur
Amfoliet
Kijk je nu opnieuw naar het voorbeeld van zwavelzuur dan is er met het -deeltje iets speciaals aan de hand: Het kan zoals hierboven aangegeven een afstaan, en is dus een zuur, maar het kan óók een opnemen en is dus ook een base! Het waterstofsulfaat-ion is een amfoliet.
Maar ook:
Maar ook:
- Zwavelzuur, , is het geconjugeerde zuur van waterstofsulfaat en
- Sulfaat, , is de geconjugeerde base van waterstofsulfaat.
Amfoliet