Basiskennis chemie/Classificatie van stoffen/Stoffen/Mengsels
Mengsels
[bewerken]Een mengsel is een stof welke bestaat uit twee of meer zuivere stoffen die fysisch met elkaar zijn gemengd. Een mengsel bestaat uit één hoofdcomponent, die zich in een vaste, vloeibare of gasvormige fase bevindt en één of meer opgeloste stoffen die zich in vaste, vloeibare of gasvormige fase bevinden. Door het mengen ontstaan geen nieuwe stoffen. De aanwezige zuivere stoffen in een mengsel kunnen door fysische processen worden gescheiden.
Naar gelang de mate van oplossing van de opgeloste stoffen onderscheidt men:
- Homogene mengsels: ook wel oplossingen genaamd, zijn mengsels waarbij het oplosmiddel en de opgeloste stoffen zodanig met elkaar zijn gemengd dat ze niet meer afzonderlijk waarneembaar zijn, de deeltjes diameter van de opgeloste stoffen zijn kleiner dan <10-9 m. Oplossingen zijn altijd helder en nooit troebel. Enkele voorbeelden:
- Bier: een oplossing van alchohol (vloeibaar) in water (vloeibaar)
- Spuitwater: een oplossing van kooldioxide (gas) in water (vloeibaar)
- Zeewater: een oplossing van zout (vaste stof) in water (vloeibaar)
- Lucht: een oplossing van zuurstofgas (gas) in stikstofgas (gas)
- Brons: een oplossing van tin (vast) in koper (vast), ook wel legering genaamd
- Heterogene mengsels: zijn mengsels waarin men ten minste één van de componenten kan onderscheiden. De deeltjesdiameters van deze opgeloste stoffen, ook wel dispers genaamd, zijn groter dan 10-7 m. Enkele voorbeelden:
- Emulsie: mengsel van kleine vloeistofdruppeltjes die in een andere vloeistof zweven zodat de vloeistof troebel is, bijvoorbeeld olie in azijn
- Suspensie: mengsel van kleine vaste stofdeeltjes die in een vloeistof zweven zodat de vloeistof troebel is, bijvoorbeeld krijtstof in water
- Schuim: mengsel van een gas in een vloeistof, bijvoorbeeld zeepsop
- Nevel: (of vloeibare aërosol) mengsel van kleine vloeistofdruppeltjes verdeeld in een gas, bijvoorbeeld mist
- Rook: (of vaste aërosol) mengsel kleine fijne vaste stofdeeltjes in een gas, bijvoorbeeld sigarettenrook
- Vast Schuim: mengsel van een gas in een vaste stof, bijvoorbeeld schuimrubber
- Gel: mengsel van een vloeistof in een vaste stof, bijvoorbeeld gelatine
- Colloïde mengsels: zijn mengsels waarvan de deeltjesdiameter van de opgeloste stoffen tussen die van heterogene en homogene mengsels ligt.
Bij heterogene mengsels zijn de stoffen niet uniform verdeeld, waardoor de eigenschappen van het mengsel lokaal verschillend zijn. Bij homogene mengsels zijn de stoffen uniform verdeeld en heeft het mengsel uniforme eigenschappen.
De aantrekkingskrachten tussen de deeltjes van een zuivere stof heten cohesiekrachten en die tussen de deeltjes van twee verschillende zuivere stoffen heten adhesiekrachten. Als de adhesiekrachten veel sterker zijn dan de cohesiekrachten, ontstaat een homogeen mengsel. Als de cohesiekrachten veel sterker zijn, ontstaat een heterogeen mengsel. Als de cohesiekrachten maar een klein beetje sterker zijn dan de cohesiekrachten, ontstaat een colloïdaal mengsel waarbij kleine deeltjes, de colloïdale stof, zich in het het oplosmiddel bevinden.
Scheiden van Mengsels
[bewerken]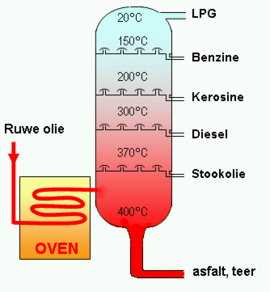
Het scheiden of ontleden van mengsels in zuivere stoffen houdt chemici al eeuwenlang bezig. Deze nadruk op scheiden is waar de benaming "scheikunde" haar oorsprong vindt.
Het doel van het ontleden van mengsels is veelledig. Zo kan een mengsel bestaan uit verschillende waardevolle componenten. Het scheiden van het mengsel in deze componenten maakt het dan mogelijk deze componenten afzonderlijk te benutten. Een voorbeeld is de raffinage van ruwe olie in producten zoals LPG, benzine, kerosine, diesel, stookolie, asfalt en teer.
Een mengsel kan ook bestaan uit veel waardeloze stoffen en een enkel waardevolle stof. Het doel is dan deze ene stof uit het mengsel te isoleren. Ook kan het zijn dat een mengsel voor het overgrote deel uit waardevolle stoffen bestaat, maar voor een klein deel uit verontreinigingen. Het doel is dan het mengsel te zuiveren van deze verontreinigingen. Bijvoorbeeld rioolwater zuiveren. Tenslotte wordt bij het onderzoek naar chemische reacties het reactiemengsel ontleedt om de reactieproducten beter te kunnen identificeren.
Er bestaan vele methoden voor het scheiden van mengsels. De meeste methoden berusten op de verschillende fysische eigenschappen die de stoffen in het mengsel bezitten. We onderscheiden hier:
| Fysische eigenschap | Scheidingsmethode |
|---|---|
| Dichtheid | Bezinken/Neerslag/Precipitaat Centrifugeren |
| Deeltjesgrootte | Filtreren Zeven |
| Aanhechtingsvermogen | Adsorberen |
| Oplosbaarheid en aanhechtingsvermogen | Chromatograferen |
| Kookpunt | Destilleren Chromatograferen |
| Vluchtigheid | Indampen |
| Oplosbaarheid | Bezinken/Neerslag/Precipitaat Omkristalliseren Extraheren |
| Dampdruk | Sublimeren |
| Smeltpunt | Uitsmelten |
