Afdeling:Scheikunde/Inleiding in de algemene chemie/VSEPR
| |
VSEPR
[bewerken]Elektronenparen, gedeeld of eenzaam, stoten elkaar af en dit bepaalt de vorm van een molecuul
VSEPR (meestal uitgesproken als vesper) staat voor Valence Shell Electron Pair Repulsion, vertaald: valentieschil-elekronenpaar-afstoting of kortweg het afstotingsmodel.
Het is een theorie die goeddeels als een uitbreiding van het Lewis-model in drie dimensies beschouwd kan worden. Het idee dat moleculen drie-dimensionale voorwerpen zijn lijkt vandaag voor de hand te liggen, immers een schep suiker of een glas water is dat ook. Toch ondervond de Rotterdammer van 't Hoff met zijn boek La chimie dans l'éspace in 1874 grote weerstand, zelfs van de grote chemici van zijn tijd, zoals Adolph Kolbe, toen hij voorstelde dat de structuur van moleculen in drie dimensies bezien moest worden. De Fransman Joseph le Bel kwam overigens onafhankelijk van hem met hetzelfde idee.
Het afstotingsmodel is van veel later (1957) en sindsdien heeft de computer het mogelijk gemaakt moleculen op allerlei wijzen af te beelden. We zullen hieronder een aantal verschillende manieren van afbeelden laten zien. Er zijn ook meetmethoden ontwikkeld die het mogelijk maken de bindingslengte en -hoeken van (gas)moleculen nauwkeurig te bepalen, zodat we de vormen van allerlei moleculen goed kennen.
Elektronengebieden
[bewerken]In onze discussie van het Lewis-model hebben we kennis gemaakt met bindingen van orde 1,2 en 3 en met eenzame elektronenparen. We kunnen deze vier samenvatten onder de naam elektronengebieden. De afstotingstheorie stelt dat een molecuul ernaar streeft de hoeken tussen twee elektronengebieden altijd zo groot mogelijk te maken. Dit is niet veel anders dan een gevolg van de wet van Coulomb, immers de elektronengebieden hebben allemaal gemeen dat zij uit negatief geladen elektronen opgebouwd zijn.
Eén elektronengebied
[bewerken]In moleculen met erg weinig valentie-elektronen zoals H2 of gasvormig natrium Na2 of kalium K2 is er maar één elektronengebied, de enkele binding tussen de atomen. Het molecuul is dan een rechte halter zonder eenzame paren.

|
Twee elektronengebieden
[bewerken]Indien er rondom het centrale atoom A twee elektronengebieden zijn trachten die zo ver mogelijk bij elkaar uit de buurt te blijven. Dat betekent dat er een lineaire structuur ontstaat met een X-A-X hoek van 180 graden.
Een goed voorbeeld hiervan is het gasmolecuul Cl-Be-Cl, waarbij we de eenzame paren van de X(=Cl)-atomen even buiten beschouwing laten. Beryllium is elektronendeficiënt met maar twee valentie-elektronen en neemt daardoor soms configuraties aan die ver van de octetregel afwijken. Lineaire moleculen met twee elektronengebieden zijn echter ook mogelijk met twee dubbele bindingen zoals O=C=O (CO2) of een enkele en een driedubbele zoals in H-C≡N. De H-C-N hoek is dus 180 graden. Aan de stikstofkant van dit molecuul H-C≡N| zit een eenzaam elektronenpaar E. De hoek C-N-E is ook 180 graden. Voor de meeste technieken is dit eenzaam paar echter niet te 'zien' en het eenzaam paar wordt daarom vaak niet afgebeeld, maar de positie van een eenzaam paar kan wel de eigenschappen van een molecuul beïnvloeden.
Drie elektronengebieden
[bewerken]Indien er rond een atoom A drie elektronengebieden zijn is de geometrie die ze zo ver mogelijk uit elkaar brengt een vlakke driehoek met drie hoeken van 120 graden. Voorbeelden van een dergelijke vlakke trigonale structuur zijn
- moleculen als BF3 en AlCl3, beide met drie enkele bindingen en daarmee elektronendeficiënt (geen octet rond B of Al)
- ionen als carbonaat CO32- met drie gelijkwaardige bindingen van orde 1.333 (of drie resonantiestructuren)
- veel moleculen met een dubbele binding zoals formaldehyde (methanal) H2C=O

|

|
Deze structuur kan nog in het platte vlak weergegeven worden, maar soms wordt al, als hierboven een stereoweergave gesimuleerd door gebruik te maken van drie verschillende 'staafjes'. Een gewoon streepje wordt geacht in het vlak van de tekening (het scherm, het bord) te liggen. Een solide wig stelt een atoom voor dat uit het vlak steekt in de richting van de waarnemer. Een gearceerde wig wordt geacht naar achteren te steken, het bord of scherm in.
Indien een van de elektronengebieden wordt ingenomen door een eenzaam paar ontstaat er een gebogen molecuul met een X-A-X hoek van bij benadering 120 graden. Dat dit slechts een benadering is hoeft geen verbazing te wekken als we bedenken dat de ladingswolk van het eenzame paar best een wat andere vorm kan hebben dan die van de twee X-A bindingen. Het molecuul zal dan díé vorm aannemen waarbij de ladingswolken er elkaar zo weinig mogelijk in de weg zitten. Dit kan best bij 121 of bij 119 graden zijn.

|

|
Een goed voorbeeld van een dergelijk gebogen molecuul is SO2. Een Lewis-berekening leert dat het een eenzaam paar heeft op het zwavel atoom en twee S-O bindingen van orde 1.5 (ofwel twee resonantiestructuren met een enkele en een dubbele binding). De gemeten bindingshoek is 119 graden en beide S-O bindingen zijn 143.1 pm lang. De gebogen vorm is vooral goed duidelijk als we het eenzame paar weglaten uit de afbeelding.

|

|

|
Vier elektronengebieden
[bewerken]Het belangrijkste geval is dat van vier gebieden omdat deze structuur de basis van het merendeel van de organische chemie.

|

|
Deze structuur kan alleen in drie dimensies goed begrepen worden, omdat het zo ver mogelijk van elkaar weg plaatsen van vier gebieden leidt tot hoeken van ~109 graden in een tetraëdrische vorm. De tetraëder, het regelmatig viervlak, is daarmee een eindeloos weerkerend motief in met name de organische chemie. Er zijn zelfs chemische vakbladen naar vernoemd zoals "Tetrahedron letters".
De linkerweergave laat opnieuw het gebruik van een solide wig zien als aanduiding van een uit het vlak van tekening stekende binding en de gearceerde die juist naar achteren steekt. Het is belangrijk zich deze tekenwijze goed eigen te maken omdat het de manier is waarop men dat met de hand op een bord of op papier tekenen kan. In de organische chemie is dit de standaardnotatie.
Het archetype van deze structuur is het methaanmolecuul. We hebben de structuur daarvan eerder als Lewis-structuur uitgewerkt, maar dat resulteerde in een weergave in het platte vlak die ten onrechte de indruk wekte dat alle hoeken 90 graden zouden zijn. Alleen als we het voorbeeld van van 't Hoff en le Bel volgen en in drie dimensies denken we komen we op de juiste tetraëdrische vorm met zijn grotere hoeken van 109 graden.
 |
 |

|
In de tijd van le Bel en van 't Hoff was er nog bitter weinig bewijs dat methaan inderdaad deze vorm had. Er waren nog geen methoden om de vorm van een molecuul te bepalen. Wel kon er aangetoond worden dat wanneer de vier buuratomen (liganden) allemaal verschillend zijn (bijvoorbeeld een H, een F, een Cl en een Br atoom), er twee verschillende moleculen mogelijk zijn die elkaars spiegelbeeld zijn. Het is niet mogelijk het ene molecuul door te draaien in het andere over te voeren, net als bij een linker- en een rechterhandschoen het geval is. Men noemt dit verschijnsel chiraliteit.
Indien één van de elektronengebieden een eenzaam paar is krijgen we een trigonaal piramidale vorm. Dit is vooral goed te zien als het eenzame paar niet wordt afgebeeld, zoals in de derde weergave.

|

|

|
Een bekend voorbeeld van deze structuur is het ammoniakmolecuul |NH3 dat drie N-H bindingen plus één eenzaam paar heeft. De H-N-H bindingshoeken wijken een beetje af van 109, nl. 107.8
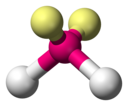
Een bekend geval met twee elektronenparen is water H2O. Het is een gebogen molecuul met een bindingshoek van iets minder dan 109 graden (gemeten: 104.45). Opnieuw is dat vooral goed te zien als we de twee eenzame paren niet afbeelden.

|
|

|
Grotere sterische getallen dan 4
[bewerken]Het aantal elektronengebieden wordt ook wel het sterisch getal genoemd. Bij zwaardere elementen is er vaak ruimte voor meer buuratomen, liganden genoemd.
Het is in sommige gevallen mogelijk het Lewis+afstotingsmodel uit te breiden door de octetregel 'uit te breiden', dat wil zeggen aan te nemen dat een atoom niet 8, maar 10 of 12 elektronen rond zich verzamelt. Deze aanname niet erg goed in overeenstemming te brengen met de resultaten van de betere golfmechanische modellen en de "uitgebreide octetregel" zal hier niet verder uitgewerkt worden.
Dat wil niet zeggen dat er geen moleculen zijn met meer liganden, integendeel! Een aantal bekende vormen staan hieronder afgebeeld. Een veelvoorkomende vorm is die van de octaëder, de vorm aangenomen door moleculen als SF6. De octaëder is in de anorganische chemie ongeveer even alledaags als de tetraëder dat is in de organische chemie.
Lewis-basen en zuren
[bewerken]Moleculen met een laag sterisch getal en moleculen met ten minste één eenzaam paar kunnen een reactie met elkaar aangaan. Het klassieke voorbeeld daarvan zijn de moleculen BF3 en NH3.
















