Chemie Centraal/Zuren
Een zuur in de scheikunde is, populair gezegd, een stof die hydroniumionen (H₃O⁺) kan afstaan. Dat doet de stof als deze bijvoorbeeld is opgelost in water.
Een zuur is in eerste instantie bekend van de smaak zuur in het normale spraakgebruik. Zuur als smaak is direct verbonden met zuur in de scheikunde. De tong in de mond heeft de mogelijkheid om zuur vast te stellen door de aanwezigheid van waterstofionen in het speeksel. De smaakreceptorcel wordt door de aanwezigheid van het waterstofion, dat positief geladen is, geactiveerd, waardoor de mens een smaak als zuur waarneemt.
De oerdefinitie
[bewerken]Zure stoffen zoals azijn of citroensap waren al heel lang bekend en hetzelfde geldt voor hun tegenvoeters, de basen. Men loogde bijvoorbeeld houtas (potas) uit door er water op te druppelen. De verkregen basische loogoplossing werd onder andere gebruikt om met oliën en vetten zeep te vervaardigen.
Verder kende men lakmoes, de kleurstof die onder andere in rode kool zit. Deze stof is een indicator die rood is in aanraking met zuren, maar blauw wordt als er een base (loog) bijgevoegd wordt.
Bij het bereiden van voedsel voegde men soms wat zuur toe om de smaak te verbeteren, bij vis bijvoorbeeld. Basen hebben namelijk een onaangename, bittere smaak en zuren maken die ongedaan. Maar men doet dit ook bij rode kool, die dan een mooie rode kleur krijgt.
Nog voor men ontdekt, had dat lucht voor een deel uit zuurstof bestond, begon men al oxiden ("kalken") van allerlei elementen te onderzoeken en vond dat sommige, zoals zwaveloxide of kooldioxide, in contact met water, zure eigenschappen hadden, andere, zoals calciumoxide, juist basische. Dit was met indicatoren zoals lakmoes en later vele andere goed te zien
Oxiden werden zo ingedeeld in vier groepen:
- zuurvormende (zoals SO2, SO3, CO2 maar ook CrO3)
- basische (zoals CaO, Na2O, maar ook Cr2O3)
- amfotere (die soms als een zuur, dan weer als een base optraden zoals Al2O3
- indifferente (zoals CO dat niet reageert in water)
In het algemeen zijn oxiden van metalen aan de linkerkant van het periodiek systeem basisch, vooral als ze een laag oxidatienummer hebben. Oxiden met een hoog oxidatienummer, vooral van de niet-metalen aan de andere kant van de tabel, zijn juist erg zuur.
Bij elementen die meerdere oxidatietoestanden hebben, zoals chroom, zijn de hogere eerder zuur, de lagere eerder basisch.
Deze oxidetheorie van Lavoisier verklaarde al een heleboel en men dacht daarom -ten onrechte- dat zuurstof altijd nodig was om een zuur te vormen. Op deze manier kwam zuurstof zelfs aan zijn naam: de "zuurvormer".
Het bleek echter dat een bekend zuur, zoutzuur, alleen maar waterstof en chloor bevatte en zo was er duidelijk een andere zienswijze nodig.
Definitie volgens Arrhenius
[bewerken]Arrhenius was een Zweedse scheikundige en Nobelprijswinnaar uit de 19e eeuw die van de zuurstofdefinitie afstapte en de aandacht op waterstof richtte. Arrhenius postuleerde dat een stof een zuur is als het minstens een waterstofatoom bevat en in staat is dat als positief ion af te geven in water. Dit wordt dissociatie genoemd.
Bekende voorbeelden van dergelijke stoffen zijn azijnzuur (CH3COOH), zwavelzuur (H2SO4) en zoutzuur (HCl).
Zwavelzuur kan splitsen volgens:
- H2SO4 H+ + HSO4−
- zwavelzuur waterstofion + waterstofsulfaat
en zelfs nog verder volgens:
- HSO4− H+ + SO42−
- waterstofsulfaat waterstofion + sulfaat
Zoutzuur kan splitsen volgens:
- HCl H+ + Cl−
- zoutzuur waterstofion + chloride
Azijnzuur in water splitst (gedeeltelijk) als volgt:
- CH3COOH H+ + CH3COO−
- azijnzuur waterstofion + acetaat
Het acetaat, waterstofsulfaat, sulfaat en het chloride noemt men de zuurrest. Overigens zijn niet alle waterstofatomen altijd afsplitsbaar. De drie H's van de CH3- (methyl-) groep in azijnzuur zijn dat niet.
Alle bovenstaande reacties zijn overigens geschreven volgens de -inmiddels achterhaalde- inzichten van Arrhenius. Later bleek het afgesplitste H+ zich in water altijd aan een watermolecuul hecht (zie verderop voor de uitleg).
Wat Arrhenius als basen zag waren de hydroxiden zoals NaOH, Ca(OH)2 enz die in water het hydroxylion OH- afsplitsen.
Er was al lang bekend dat zuren en basen elkaar neutraliseerden: ze hieven elkaar als het ware op. (Vandaar het citroensap op de vis). Arrhenius zag neutralisatie als een reactie tussen de H van een zuur en de OH van een Arrhenius-base (oftwel hydroxide), bijvoorbeeld tussen salpeterzuur en natronloog
- NaOH + HNO3 ==> NaNO3 + H2O
De tegenionen, de 'zuurrest' en de 'baserest' vormden samen een zout. De zouten werden genoemd naar het zuur, bijvoorbeeld sulfaten van zwavelzuur, acetaten naar azijnzuur. In dit geval krijgen we natriumnitraat, waarvan de ionen gewoon in oplossing blijven. In zekere zin zijn zij dus niet meer dan bijstanders en vindt de neutralisatie plaats tussen H+ en OH- onder de vorming van water:
- H+ + OH- H2O
Deze reactie is een evenwicht dat zelfs in het puurste water voorkomt en een evenwichtsconstante Kw=10-14 heeft. Ook hier geldt dat later ontdekt is dat een 'kaal' proton H+ niet echt voorkomt in water. We moeten eerder aan H3O+ denken:
- H3O++ OH- 2H2O.
De theorie van de zure en basische oxiden raakte hiermee aardig op de achtergrond, omdat niet langer CaO en SO3 als base- en zuurvormers gezien werden, maar hun reactieproduten met water Ca(OH)2 en H2SO4.
Dat gold ook voor ammonia. Ook dat werd gezien als een reactieproduct van ammoniakgas NH3 met water:
- NH3 + H2O ==> "NH4OH"
Dit "ammoniumhydroxide" werd dan geacht OH--ionen af te splitsen.
Het probleem was dat dit hydroxide "NH4OH" niet in zuivere vorm te bereiden was, hoewel de oplossing van ammoniakgas wel sterk basische eigenschappen had en er een hele reeks ammoniumzouten van afgeleid kunnen worden. Iets dergelijks gold voor CO2, dat geeft de lichtzure oplossing bekend van priklimonades, maar 'koolzuur' "H2CO3" is nooit aangetoond....
Dit probleem is vrij algemeen, er zijn namelijk een heleboel zouten die 'afgeleid' zijn van een 'zuur' dat nog nooit is aangetoond, de zogenaamde 'hypothetische zuren', waarvan koolzuur het bekendste voorbeeld is.
Een ander probleem was dat men ook in andere oplosmiddelen dan water begon te werken, waarin vergelijkbare chemische verschijnselen optraden als in water, maar de Arrheniustheorie ging eigenlijk alleen op in water. De Arrhenius-theorie had dus duidelijk zijn tekortkomingen.
Definitie volgens Brønsted en Lowry
[bewerken]
De Deense Brønsted en de Engelse Lowry waren twee scheikundigen die de definitie van Arrhenius te beperkt vonden en deze in 1923 -overigens onafhankelijk van elkaar- uitgebreid hebben. Zij kijken niet zo zeer naar een hele stof die in water opgelost wordt, maar meer naar een enkel molecuul of ion in een oplossing (in water of iets anders).
Een dergelijke stof noemt men een protondonor.
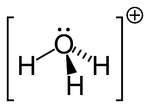
Een groot verschil is dat er geen water in een reactie betrokken hoeft te zijn, een ander verschil is dat we het niet over in zuivere toestand verkijgbare stoffen, maar over moleculen of ionen hebben. Reacties waar geen molecuul water in voorkomt, kunnen nog steeds reacties tussen zuren en basen zijn. Deze definitie is dus ruimer, en het betekent wel dat Arrhenius-zuren ook Brønsted-zuren zijn.
Een ander verschil is dat water niet langer een bijstander (oplosmiddel genaamd) is, maar zelf als base of zuur kan optreden. Water treedt bijvoorbeeld op als protonacceptor (d.w.z. een base), want het molecuul reageert met een vrijkomend proton (waterstofion) volgens:
- H2O + H+ H3O+
- water + waterstofion hydroxonium-ion
Met deze definitie is het ammoniakprobleem goed op te lossen. We kunnen ammoniak zien als een protonacceptor (een base) en water als een protondonor (een zuur):
- NH3 + H2O => NH4+ + OH-
We zijn hiermee van het (onbestaande) "NH4OH" af!
Een ander, belangrijk, door Brønsted en Lowry ingevoerd begrip is dat van de geconjugeerde basen en zuren.
- NH3 is hier de base en NH4+ zijn geconjugeerd zuur.
- H2O is hier het zuur en OH- de geconjugeerde base
Arrhenius zou NH4+ nooit een zuur genoemd hebben, hoogstens een 'baserest' en H2O was voor hem geen zuur maar een oplosmiddel.
Hoewel Brønsted en Lowry met hun definitie een veel uitgebreider toepassingsgebied voor het zuur-basebegrip veroverden, (ook in andere oplossmiddelen dan water) bleef het CO2 probleem even groot als voorheen. Dit molecuul heeft geen waterstof en kan er ook geen opnemen en toch vormt het een zure oplossing... Hetzelfde geldt overigens voor een aantal andere van de oude 'zuurvormende oxiden'. We zitten dus nog steeds met een hoop 'hypothetische' zuren.
Inmiddels was de opbouw van het atoom al een stuk duidelijker geworden en besefte men dat de reden dat NH3 een base is, dat het een eenzaam elektronenpaar heeft (:NH3) waar een vierde proton aan gehangen kan worden. Dit inzicht gaf aanleiding tot opnieuw een uitbreiding van de definitie van wat een zuur of een base is.
Definitie volgens Lewis
[bewerken]Lewis was een Amerikaans scheikundige die de definitie van Arrhenius, maar ook die van Brønsted/Lowry, nog steeds te beperkt vond. Immers deze definitie was nog steeds afhankelijk van één bepaald element, namelijk waterstof. Lewis stelde -in hetzelfde jaar 1923- dat het bij een zuur-basereactie niet ging om protonen maar om elektronenparen. En daarmee werd de definitie onafhankelijk van een bepaald element.
Zijn definitie van een base is in feite een omkering van Brønsteds definitie: in plaats van een proton aan een elektronenpaar te hangen, hangen we een elektronenpaar aan een proton!
Daarmee zijn alle Brønsted-basen ook Lewis-basen en omgekeerd, zodat de omkering niet veel lijkt uit te maken, maar het ligt dan voor de hand om een zuur als volgt te definiëren:
Deze omkering maakt veel verschil. Bijvoorbeeld, een proton is nu zelf een zuur geworden, omdat het een elektronenpaar kan aanvaarden! Volgens de definitie van Lewis zijn daarmee alle zuren volgens de definitie van Brønsted en Lowry ook Lewis-zuren, omdat we elektronenparen aan hun protonen kunnen hechten.
Maar we kunnen ook elektronenparen aan andere zaken gaan hechten dan alleen een proton en dat stelt ons in staat om eindelijk het koolzuurprobleem oplossen. Bijvoorbeeld als we CO2 oplossen in een basische oplossing met een hoop hydroxylionen krijgen we:
- CO2 + :OH- => HCO3-
Het CO2 molecuul heeft twee dubbele bindingen O=C=O. Het koolstofatoom heeft dus maar twee elektrongebieden rond zich. Het kan dus gemakkelijk een van de elektronenparen van :OH- opnemen om binding met een extra zuurstofbuur aan te gaan. Het elektronenpaar van het :OH- ion wordt dus hier niet aan een proton gehangen, maar aan een koolstofatoom dat nog wel een buurtje kan gebruiken.
Het grappige is dat dit eigenlijk een stukje eerherstel is van de oude zuurstofdefinitie. De oude zuurvormende oxiden zijn zuren in de nieuwe Lewis-definitie!
Dit is een enorme uitbreiding van het werkterrein van de zuren en basen, omdat we nu niet alleen onafhankelijk van zuurstof, maar ook onafhankelijk van waterstof (en water) zijn. De definitie is ook veel meer in overeenstemming gekomen met nieuwere theorieën over het golfkarakter van de elektronen in een atoom.
Typische Lewiszuren zijn AlCl3 (aluminiumtrichloride), BF3 (boriumtrifloride) en SiF4 (silicumtetrafluoride). Ook de ionen Co3+ en het Cu2+ zijn Lewiszuren. In feite zijn alle kale metaalionen een Lewiszuur omdat we er liganden aan kunnen plakken die eenzame elektronenparen aanbieden.
De vraag wat iets een goed Lewis-zuur maakt is zonder ingewikkelde berekeningen niet zo eenvoudig te beantwoorden, maar er zijn wel wat vuistregels te geven. Bevorderend voor zuur karakter zijn
- een hoge lading
- een 'kaal' atoom of ion (weinig buren)
- een incompleet octet (zoals bij AlCl3 BF3)
Een typische reactie is bijvoorbeeld deze:
- AlCl3 + Cl− AlCl4−
- aluminiumtrichloride + chloride aluminiumtetrachloride-ion
De binding die wordt aangegaan is een covalente binding.
Ook de grootte speelt een rol. Bijvoorbeeld UF6 is een Lewis-zuur hoewel er al 6 liganden zijn. Uraan is zo groot dat er best plaats is voor een zevende fluor en de vorming van een UF7-.
Geleidbaarheid van een zure oplossing
[bewerken]Arrhenius-zuren zijn in het algemeen goed oplosbaar in water. Bij het oplossen van zo'n zuur in water zal het opsplitsen in een positief waterstofion, dat met water een positief hydroxonium-ion vormt en een negatieve zuurrest. In het water bevinden zich nu dus een groot aantal ionen. De ionen zorgen ervoor dat stroom door water kan geleiden. Een oplossing van een zuur in water is dus geleidend.
Hetzelfde kan gezegd worden van Arrhenius-basen, behalve dat zij vaak slecht oplosbaar zijn. De alkalimetaalhydroxiden zoals NaOH en KOH zijn daar een uitzondering op. Zij lossen goed op en geven goed geleidende oplossingen.
Wanneer is een stof zuur
[bewerken]Niet alle stoffen die waterstof bevatten, zijn zuren. Alleen stoffen waarvan de zure vorm stabiel is, geven "gemakkelijk" een waterstofatoom af en zijn daarom zuur.
Een voorbeeld is HCl. Door de grote elektronegativiteit van chloor is de stof Cl- stabiel: het chlooratoom bereikt namelijk een octetstructuur. Analoog voor alle zuren gevormd uit halogenen. De sterkte van deze zuren neemt toe van HF, via HCl en HBr naar HI. Voor een deel kunnen we dat met eenvoudige toepassing van de wet van Coulomb verklaren. Immers de afstand r tussen beide kernen neemt toe omdat jodium veel groter is dan fluor en formeel zijn de ladingen q+=+1 voor H en q-=-1 voor het anion. De aantrekking gaat volgens Coulomb als:
Omdat r groter wordt komt het proton losser te zitten, want F wordt kleiner. Dit verklaart ook waarom de serie H2O,H2S,H2Se en H2Te veel minder zuur is: het centrale ion is nu X2-, zodat q-=-2 is en F twee keer zo groot wordt. Bovendien worden de bindingen minder ionogeen en dus sterker.
Voor op oxiden gebaseerde zuren en basen geldt iets vergelijkbaars. Als we een groep ...-M-O-H bekijken wordt de afstoting tussen M en H (beide positief!) groter als M een grote positieve lading en een kleine straal heeft. Dit is bijvoorbeeld waar voor S6+. Zwavelzuur is daarmee een sterk zuur. Omgekeerd als M groot is en een kleine lading heeft, zoals bij Cs+ zit het proton goed vast aan het zuurstofatoom, maar zij kunnen samen gemakkelijk als -1 hydroxyl-ion het grote +1 cesium-ion verlaten, net als bij HI het geval was. CsOH is dus een sterke base en LiOH veel minder sterk.
Dit verkaart ook het amfotere karakter van Al(OH)3. Aluminium ligt halverwege de beide extremen in lading en in grootte. In sterk zuur milieu verlaten de OH- ionen het Al3+-ion. In sterk basisch milieu zijn het de protonen die het 'aluminiumzuur' H3AlO3 verlaten en krijgen we aluminaten. We kunnen dezelfde stof net zo goed als base (Al(OH)3) of als zuur (H3AlO3) schrijven.
Bij carbonzuren CH3COOH: speelt iets anders. Daar is het gevormde CH3COO- wat stabieler door resonantie over de beide O-atomen van de COO- groep.
Andere koolstofverbindingen dan de carbonzuren, zoals methaan CH4, ... daarentegen zijn niet zuur, omdat de C-H binding vrijwel geheel covalent is en er bij het verwijderen van een waterstofatoom een zeer instabiel molecuul (carbanion) ontstaat.
Bij carbonzuren spelen buuratomen soms een versterkende of verzwakkende rol. Bijvoorbeeld, in CF3COOH is het proton sterker zuur dan in CH3COOH omdat de fluoratomen aan het buuratoom elektronen 'wegzuigen' van de COOH groep.
Voor basen gelden overeenkomstige argumenten. Bijvoorbeeld :NH3 is een sterkere base dan ::OH2 (lees: water) omdat het elektronegatieve zuurstof zijn elektronenparen dichter aan zijn borst trekt. :NF3 wordt ook een stuk zwakker omdat de fluor atomen lading wegzuigen en het elektronenpaar dus minder uitpuilt. Daarentegen is :N(CH3)3 een stuk sterker als base omdat de methylgroepen juist lading aan het stikstofatoom opdringen.
Sterkte van een zuur
[bewerken]Niet alle zuren in water dissociëren compleet; daarom spreken we van sterke en zwakke zuren.
Voorbeelden van sterke anorganische zuren zijn:
zuur zuurrest HClO4 perchloorzuur ClO4- chloraat H2SO4 zwavelzuur SO42- sulfaat HI waterstofjodide I- iodide HBr waterstofbromide Br- bromide HCl waterstofchloride Cl- chloride HNO3 salpeterzuur NO3- nitraat H3O+ het hydroxonium-ion H2O water
Er stelt zich een evenwicht in, dat weergegeven wordt door een dubbele pijl:
- HA(aq) H+(aq) + A-(aq)
- Opmerking:
Deze dubbele pijlen: moeten we niet verwarren met . Het laatste symbool geeft resonantie aan, het eerste evenwicht. Bij evenwicht moeten hele moleculen of atomen zich bewegen. Dit is veel trager dan de herverdeling van elektronen die door resonantie aangegeven wordt.
Voorbeelden van zwakke anorganische zuren zijn:
| zuur | zuurrest | ||
|---|---|---|---|
| H3PO4 | fosforzuur | PO43- | fosfaat |
| HF | waterstoffluoride | F- | fluoride |
| HSO3 | zwaveligzuur | SO3- | sulfiet |
| HNO2 | salpeterigzuur | NO2- | nitriet |
| H2S | waterstofsulfide | S2- | sulfide |
Voorbeelden van zwakke organische zuren zijn:
| zuur | zuurrest | ||
|---|---|---|---|
| CH3COOH | azijnzuur | CH3COO- | acetaat |
| HCOOH | methaanzuur (mierenzuur) | HCOO- | methanaat (formiaat) |
| C2H4COOH | propaanzuur (propionzuur) | C2H4COO- | propanaat (propionaat) |
pH
[bewerken]Wat is zuurder? Een sinaasappel (appelsien) of een citroen? Eigenlijk weten we dat allemaal wel: dat is een citroen. Dit kan je ook meten en wel door het bepalen van de concentratie van hydroxoniumionen in een oplossing.
In het begin van de 20e eeuw werd daarvoor het begrip pH (let op: kleine p en grote H) geïntroduceerd. De p staat voor potentie/kracht en de H staat voor waterstof. De pH is een maat voor de zuurgraad van een oplossing. Het is een logaritmische schaal.
De pH is gelijk aan de negatieve logaritme (grondtal 10) van de concentratie waterstofionen (H+), uitgedrukt in mol/liter.
In formulevorm:
In water bestaat een evenwicht tussen H3O+ hydroxonium en hydroxyl OH-:
- 2H2O H3O+ + OH-
De evenwichtsconstantie Kw = [H3O+][OH-] = 10-14
Dat betekent dat in zuiver water [H3O+] en [OH-] aan elkaar gelijk moeten zijn omdat de bovenstaande reactie de enige bron is van beide ionen. Voor ieder H3O+-ion wordt er immers ook een OH--ion gevormd. Dit betekent dat [H3O+]=[OH-]=10-7 zodat de pH in neutraal water 7 is.
Als we wat zuur toevoegen, bijvoorbeeld door het aantal H3O+-ion tien keer zo hoog te maken (10-6 dus), moet het aantal hydroxyl-ionen met dezelfde factor omlaag (10-8). Het waterevenwicht eist dat omdat [H3O+][OH-] = 10-6x10-8=10-14.
Als we alleen naar de exponenten kijken hebben we nu dus pH=6 en pOH=8. (De som van deze twee is altijd 14!)
Als we juist wat base hadden toegevoegd en er tien keer zo veel hydroxyl-ionen gekomen waren was pOH zes geworden, en pH dus 8.
In het algemeen hebben we daarom:
- pH<7: zuur
- pH=7: neutraal
- pH>7: basisch
Hoe verder pH afwijkt van 7, hoe sterker een oplossing zuur of basisch is.
We kunnen de pH op verschillende manieren meten. Er zijn een hele batterij indicatoren die allemaal bij hun eigen pH waarde van kleur veranderen. Maar er zijn ook pH-meters die in de oplossing gestoken worden en langs elektrochemische weg de pH omzetten in een gemeten voltage.
Enige zuren onder de loupe
[bewerken]Zwavelzuur
[bewerken]
Zwavelzuur is een sterk zuur. Het is gevaarlijk omdat het etsend werkt, maar de stof is ook een sterke oxidator en een bijzonder sterk wateronttrekkend middel. Contact tussen huid of ogen moet dan ook altijd worden vermeden. Maar ook de kleding loopt gevaar. De stof heeft de neiging een fijne nevel te vormen en de microscopische druppeltjes hechten zich aan weefsels waar ze water aan onttrekken zodat er gaten in vallen. Geconcentreerd zwavelzuur hoort daarmee echt in een goedwerkende zuurkast!
Zwavelzuur wordt verkregen door zwavel te verbranden.
In aanwezigheden van een katalysator gaat SO2 een evenwichtsreactie aan met zuurstof:
Het trioxide wordt in zwavelzuur (!) geleid waarbij de volgende reactie optreedt:
En dat reageert weer verder met water volgens:
Er is een efficiëntere manier om SO2 om te zetten in SO3, namelijk met vanadiumoxide en dat gaat volgens:
Het V2O4 kan hergebruikt worden nadat het op eenvoudige wijze met zuurstof reageert.
De reactie van zwavelzuur met water doet veel warmte vrijkomen en dit kan tot gevaarlijk gespat leiden. Voeg nooit water bij geconcentreerd zuur, maar altijd andersom: dan kan de warmte beter weg. Dit is ook de reden waarom het trioxide eerst in zwavelzuur opgelost wordt, oplossen in water is te gevaarlijk.
Het dioxide kan wel in water opgelost worden en vormt dan een veel zwakker zuur, zwaveligzuur geheten (H2SO3). De afgeleide zouten heten sulfieten.
Salpeterzuur
[bewerken]
Salpeterzuur is een sterk zuur en heet officieel waterstofnitraat.
Salpeterzuur is een van de belangrijkste grondstoffen in de procesindustrie. Het wordt onder andere ingezet bij de productie van andere zuren, fosfaten en voor de productie en extraheren van stoffen uit ertsen, in batterijen en voor het etsen van metalen en halfgeleiders.
Het wordt voornamelijk geproduceerd met het Ostwald-proces dat verloopt met de volgende reacties:
Salpeterzuur wordt in de industrie veel gebruikt, het is onder andere belangrijk voor het oplossen van metalen, waardoor dat metaal uit ertsen kan worden vrijgemaakt. Het kan ook gebruikt worden als oxidator, als grondstof (nitraat) voor springstof en kunstmeststof en in verfstoffen en desinfecterende stoffen.
Salpeterzuur gemengd met zwavelzuur in zo weinig mogelijk water heet nitreerzuur. Gemengd met geconcentreerd zoutzuur onstaat koningswater dat zelfs edele metalen als goud oplost.
Zoutzuur
[bewerken]
Zoutzuur is een oplossing van HCl in water. Puur waterstofchloride is gasvormig, maar lost goed op in water. Het is een sterk anorganisch zuur en is etsend. Ook voor dit zuur geldt dus dat men er erg mee moet oppassen en de veiligheidsvoorschriften in acht neemt.
In het laboratorium kan men zoutzuur als volgt maken:
In de industrie wordt het als volgt geproduceerd:
Het gas wordt opgelost in water:
Zoutzuur kan ook ontstaan als afvalproduct bij de productie van andere chemicaliën.
Zoutzuur wordt gebruikt bij de verwerking en opwerking van ertsen en bij de metaalverwerking bijvoorbeeld voor het etsen. Bovendien wordt het voor analytische doeleinden in laboratoria ingezet.
Zoutzuur gemengd met salpeterzuur heet koningswater: een heel agressief zuur.
Fosforzuur
[bewerken]
Fosforzuur is een zwak zuur dat dissocieert in 4 verschillende toestanden afhankelijk van de heersende pH in de oplossing. Het kan zich in de toestand fosfaat (PO43-), monowaterstoffosfaat (HPO42-), diwaterstoffosfaat (H2PO4-) en triwaterstoffosfaat (H3PO4)bevinden.
Het fosforzuur wordt gemaakt door fosfaaterts (meestal apatiet) te laten reageren met zwavelzuur, waarbij fosforzuur en gips wordt gevormd (alternatief met zoutzuur of salpeterzuur). Ook kan men puur fosfor verbranden en hydrolyseren in water.
Koolzuur
[bewerken]Koolzuur is een oplossing van koolstofdioxide (CO2) in water. Het koolstofdioxide vormt een molekuul met water dat eigenlijk diwaterstofcarbonaat heet. Koolzuur is een zwak zuur dat niet in zuivere vorm te isoleren is en dat 1 of 2 H+-ionen kan afsplitsen.
Koolzuur (en bicarbonaat) wordt veel gebruikt in de voedingsmiddelenindustrie. Denk daarbij bijvoorbeeld aan cola of sinas, waar de CO2 vrijkomt als belletjes in het glas limonade. Een bruistablet is ook een mooi voorbeeld, daar bevindt zich bicarbonaat en citroenzuur als vaste stof (dat niet met elkaar reageert) in de tablet. Los je dit op in water dan reageert de bicarbonaat met het citroenzuur en vormt daarbij volgens bovenstaande reactie (maar dan van rechts naar links) koolstofdioxide; en dat bruist. Ook bakpoeder werkt op de manier zoals beschreven bij het bruistablet en zorgt er dus voor dat het deeg rijst.
Azijnzuur
[bewerken]
Azijnzuur is een zwak organisch zuur. Het bekendste voorbeeld van azijnzuur is de tafelazijn.
Een bekende bereidingswijze van azijnzuur is het fermenteren van alcohol; bijvoorbeeld wijn die te lang staat (of waar een bacterie bij is gekomen) zal bederven en ruikt en smaakt dan zuur.
Industrieel wordt het echter op een andere wijze geproduceerd:
In aanwezigheid van een katalysator en met verhoogde druk laat men methanol reageren met koolstofmonoxide
Azijnzuur wordt gebruikt als grondstof voor ethylacetaat dat een belangrijk oplosmiddel is. Met salicylzuur reageert azijnzuur tot acetylsalicylzuur; het belangrijkste bestanddeel van aspirine.
Azijnzuur wordt veel ingezet als smaakstof, een zuurmiddel in de voedingsmiddelenindustrie, evenals de acetaten kaliumacetaat, natriumacetaat en calciumacetaat. Azijnzuur is ook bestanddeel van cosmetica als crème en zeep.
Citroenzuur
[bewerken]


Citroenzuur is ook een zwak organisch zuur. De systematische naam is 2-hydroxypropaan-1,2,3-tricarbonzuur. Citroenzuur heet zo omdat het door zijn ontdekker uit het sap van citroenen werd gewonnen.
Citroenzuur is belangrijk omdat het een centrale rol speelt in de citroenzuurcyclus, een biochemisch proces dat deel is van het metabolisme van mens en dier. Daarnaast wordt het gebruikt als zuurteregelaar in de voedingsmiddelenindustrie en als schoonmaakmiddel (dat dan ook lekker ruikt) en zoals je al hebt kunnen lezen in bruistabletten. Citroenzuur vindt men ook veel in planten, zoals je reeds hebt gelezen in citroenen, maar ook in andere citrusvruchten.
De industriële winning van citroenzuur maakt gebruik van citrusvruchten als grondstof. Ook kan men citroenzuur op biochemische wijze produceren met een speciale bacterie uit glucose en zuurstof.
Alkaanzuren
[bewerken]Een alkaanzuur is een zuur gevormd uit een alkaan waarin een H-atoom vervangen is door aan COOH-groep (carboxylgroep genoemd). De algemene formule voor alkaanzuren is CnH2n+1COOH.
| formule | rationele naam | traviale naam | structuurformule |
|---|---|---|---|
| H-COOH | methaanzuur | mierenzuur | 
|
| CH3-COOH | ethaanzuur | azijnzuur | 
|
| HOOC-(CH2)5-COOH | heptaandizuur | pimelinezuur |






![{\displaystyle pH=-\log \left[\mathrm {H_{3}O^{+}} \right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/29a1f4c1a114abe42d67f08b5bf58ca15e42a112)













