Organische chemie/Carbonzuren
Carbonzuren worden gekenmerkt door de aanwezigheid van een carbonzuurgroep in het molecuul. Een carbonzuurgroep bestaat uit:

- een koolstofatoom.
- een zuurstofatoom dat met een dubbele binding aan het koolstofatoom gebonden is.
- een zuurstofatoom dat met een enkele binding aan het koolstofatoom gebonden is. De tweede binding aan dit zuurstofatoom wordt door waterstof bezet.
De vierde binding van het koolstofatoom wordt gebruikt om de carbonzuurgroep aan de rest van het molecule te koppelen. In algemene structuurformules wordt de "restgroep" vaak aangegeven met "R", zoals in de figuur hiernaast
Weergave en omschrijving
[bewerken]De carbonzuurgroep wordt in tekst vaak aangeduid met "zuurgroep". Wordt een structuurchemische notatie gebruikt dan zie je vaak -COOH staan. In structuurformules wordt de carbonzuurgroep vaak ook zo weergegeven. Soms wordt een paar ronde haken gebruikt om aan te geven dat een van de zuurstofatomen alleen aan het koolstof-atoom vastzit en geen onderdeel uitmaakt van een keten: -C(O)OH.
In de bespreking van de carbonzuren kan, als alleen de zuurgroep ter sprake komt, het molecule genoteerd worden als R-COOH.
Zure eigenschappen
[bewerken]Op het eerste gezicht lijkt de carbonzuurgroep erg op de structuur van alkanolen: koolstof met daaraan een OH-groep. In alkanolen is het mogelijk het waterstofatoom van zuurstof te laten reageren, maar alleen met hele sterke basen en in afwezigheid van water. Zuren zijn in staat ook in water hun waterstof af te splitsen. Twee zaken spelen een rol, de ene in het niet geïoniseerde zuur, de andere juist in de zuurrest:
- In het neutrale zuur (R-COOH) bevindt de OH-groep zich aan een koolstof waar ook een dubbel gebonden zuurstof aanzit. Het zuurstof atoom is elektronegatiever dan het koolstofatoom. Dat wil zeggen dat de elektronen van de koolstof-zuurstofband vaker en dichter bij het zuurstofatoom zitten, waardoor de koolstof positiever wordt dan de koolstof in een alkanol. Dit zal tot gevolg hebben dat de elektronen van de enkele koolstof-zuurstofband wat meer naar de koolstof verschuiven, (en andere elektronen op dat zuurstof-atoom ook) waardoor het waterstofatoom minder goed vastgehouden kan worden door de zuurstof dan in een alkanol. Je kan ook zeggen: het waterstofatoom wordt makkelijker afgestaan.
- In het zuurrest-ion is het mogelijk twee verdelingen van elektronen te tekenen, die beiden zoren dat alle atomen 8 elektronen in hun buitenste schil "zien". De twee structuren kunnen echter in elkaar overgaan door de elektronen een heel klein beetje te verschuiven. Het dubbel gebonden zuurstofatoom wordt enkelgebonden en krijgt de negatieve lading, terwijl het geladen enkelgebonden zuurstofatoom zijn lading kwijtraakt en dubbelgebonden wordt. Elektronen bewegen heel snel, en eigenlijk zijn de twee te tekenen structuren grensgevallen. Vergelijk het met de beschrijving van de aromatische binding. Het effect is dat de lading van het ion over een groter deel van de ruimte wordt "uitgesmeerd". In de natuurkunde is bekend dat het verspreiden van lading energiewinst oplevert. In vergelijking met het anion van een alkanol is het anion van de zuurrest stabieler.
Beide effecten betekenen dat het zuur makkelijker een H + zal afstaan dan een alkanol.
Naamgeving
[bewerken]Eenwaardige zuren
[bewerken]In de volgorde waarin groepen de uitgang van de naam van de verbinding bepalen staat de carbonzuurgroep bovenaan. Dat betekent dat bij het kiezen van een naam de langste keten wordt gekozen waarvan het koolstofatoom van de zuurgroep het eerste atoom is. Bij het tellen van de koolstofatomen in deze keten wordt het koolstofatoom van de zuurgroep meegeteld. De naam wordt vervolgens gevormd door de naam van het alkaan met hetzelfde aantal koolstofatomen met de toevoeging "zuur".
Tweewaardige zuren
[bewerken]Bevinden zich twee zuurgroepen in het molecule dan wordt de naam gebaseerd op de keten waarvan de twee koolstofatomen in de zuurgroepen deel uitmaken. Ze tellen ook mee in het aantal koolstofatomen. De naam wordt gevormd door achter de naam de de ketenlengte aangeeft de toevoeging "dizuur" te plaatsen.
Gevoelsmatig verwacht je dat een tweewaardig zuur sterker zal zijn dan een éénwaardig zuur. Dit is maar ten dele waar. Er zijn een aantal aspecten die een rol spelen.
- Als de twee zuurgroepen in het molecuul kort bij elkaar zitten zal na afsplitsen van het eerste waterstof-ion een negatief geladen plaats op het molecuul aanwezig zijn. Een tweede waterstof-ion zal daarvandaan moeilijker kunnen vertrekken. In ieder geval zal de tweede ionisatiestap daardoor zwakker zijn dan die van een eenwaardig zuur.
- Als de twee zuurgroepen zo kort bij elkaar zitten dat er een waterstofbrug gevormd kan worden waarbij een vijf- of een zes-ring ontstaat, dan zal daardoor het eerste waterstof-ion makkelijker worden afgetsaan (een deel van de elektronen die moeten zorgen voor de binding worden immers gebruikt voor de waterstofbrug naar het tweede waterstof-ion, maar het tweede waterstof-ion zit na het vertrek van het eerste in het zuurrest-ion opgesloten en kan daardoor nog lastiger vertrekken.
De aangegeven effecten zijn het sterkst voor ethaandizuur, vanaf ongeveer octaandizuur gedragen de dizuren zich ongeveer op de zelfde wijze als de monocarbonzuren. Een chromatogram van de verschillende dizuren vertoont Rf-waarden die asymtotisch tot een limietwaarde naderen.
Voorbeelden
[bewerken]| Triviale naam | Structuurformule | Systematische naam | pKz1 | pKz2 |
|---|---|---|---|---|
| Oxaalzuur | 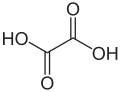 |
Ethaandizuur | 1.27 | 4.27 |
| Malonzuur |  |
Propaandizuur | 2.83 | 5.70 |
| Barnsteenzuur |  |
Butaandizuur | 4.20 | 5.60 |
| Glutaarzuur | Pentaandizuur | ? | ? | |
| Adipinezuur |  |
Hexaandizuur | ? | ? |
Drie- en meerwaardige zuren en lastige gevallen
[bewerken]Een keten heeft maar twee uiteinden. Als een molecuul drie of meer zuurgroepen bevat kunnen niet alle zuurgroepen aan het einde van een de keten zitten. Een keten heeft immers maar twee uiteinden. Daarnaast zijn er moleculen waarbij geen eind aan de langste keten zit: de cycloverbindingen en de aromaten. Het probleem wordt opgelost door:
- de zuurgroepen worden beschreven als "carbonzuur"
- alle zuurgroepen worden als aparte groep gezien, de langste keten in het molecule bevat dus geen koolstofatomen uit zuurgroepen.
- de zuurgroepen bepalen wel de uitgang van de naam.
De opmerkingen die voor de zuursterkte van de dizuren gelden, zijn ook waar voor de driewaardige zuren.
Voorbeelden
[bewerken]| citroenzuur |  |
De systematische naam voor citroenzuur is 2-hydroxy-propaan-1,2,3-tricarbonzuur |
|
benzoëzuur |
 |
De systematische naam voor benzoëzuur is benzeencarbonzuur |
|
ftaalzuur |
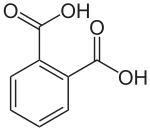 |
De systematische naam voor ftaalzuur is benzeen-1,2-dicarbonzuur |

